1 . 化学与人类生活、生产密切相关。请根据题意填空:
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是___________ (填“SiO2”或“Si”);
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为___________ (填“NaCl”或“NaClO”);
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO 2CO2+
2CO2+___________ 。
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO
 2CO2+
2CO2+
您最近一年使用:0次
名校
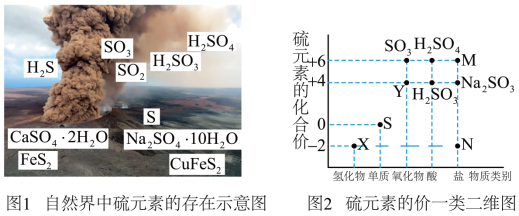
2 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 、___________ 。
(2)在X、Y、S中属于非电解质的是___________ (填化学式);X与Y反应中氧化剂与还原剂的物质的量之比为___________ 。
(3)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸以及稀硝酸和 做原料,设计了两种制取胆矾的方案。
做原料,设计了两种制取胆矾的方案。
方案甲: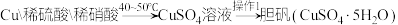
i.该方法中首先要将Cu与稀硫酸和稀硝酸混合,为了只得到 溶液,需向50mL 1.0mol/L稀硝酸中加入
溶液,需向50mL 1.0mol/L稀硝酸中加入___________ mL 1.0mol/L稀硫酸与之混合。
ii.操作1:___________ 、___________ 、过滤、洗涤和干燥
方案乙: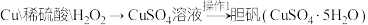
iii.该方法的化学方程式___________ 。
iv.这两种方案,你认为哪一种方案更合理?___________ (填“方案甲”或“方案乙”)。
(2)在X、Y、S中属于非电解质的是
(3)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸以及稀硝酸和
 做原料,设计了两种制取胆矾的方案。
做原料,设计了两种制取胆矾的方案。方案甲:
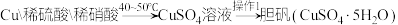
i.该方法中首先要将Cu与稀硫酸和稀硝酸混合,为了只得到
 溶液,需向50mL 1.0mol/L稀硝酸中加入
溶液,需向50mL 1.0mol/L稀硝酸中加入ii.操作1:
方案乙:
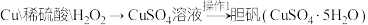
iii.该方法的化学方程式
iv.这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
名校
解题方法
3 . 研究人员拟设计黄铜矿(主要含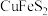 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下:
(1)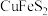 中铁元素的化合价为
中铁元素的化合价为_______ 价,已知“焙烧”生成 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为_______ 。
(2)“置换”步骤中发生的所有反应的离子方程式有
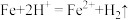 、
、_______ 。
(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、_______ 。
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是_______ (填“稀 ”或“稀
”或“稀 ”)。
”)。
(5)“反应”步骤中,10% 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:_______ 。
(6)绿矾晶体( )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为_______ 。
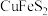 )制备硝酸铜和绿矾晶体的流程如下:
)制备硝酸铜和绿矾晶体的流程如下: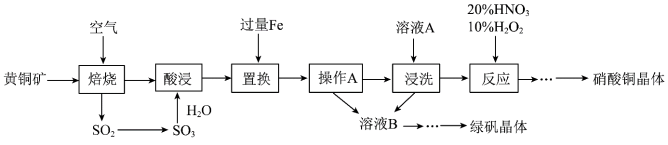
(1)
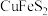 中铁元素的化合价为
中铁元素的化合价为 、CuO和
、CuO和 则其化学反应方程式为
则其化学反应方程式为(2)“置换”步骤中发生的所有反应的离子方程式有

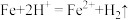 、
、(3)流程中“操作A”所需的玻璃仪器有烧杯、玻璃棒、
(4)“浸洗”步骤中加入用于分离Cu、Fe的溶液A是
 ”或“稀
”或“稀 ”)。
”)。(5)“反应”步骤中,10%
 为氧化剂,20%
为氧化剂,20% 提供
提供 ,可以避免污染性气体的产生,写出该“反应”的离子方程式:
,可以避免污染性气体的产生,写出该“反应”的离子方程式:(6)绿矾晶体(
 )在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
)在空气中极易变质;验证绿矾晶体已变质可选择的试剂为
您最近一年使用:0次
名校
解题方法
4 . 将 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收
的混合溶液中反应回收 ,其物质转化如图所示。下列说法正确的是
,其物质转化如图所示。下列说法正确的是
 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收
的混合溶液中反应回收 ,其物质转化如图所示。下列说法正确的是
,其物质转化如图所示。下列说法正确的是
| A.在图示的转化中,化合价不变的元素只有铜 |
B.根据图示可知 、 、 均能氧化 均能氧化 |
C.回收 的总反应为 的总反应为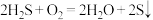 |
D.在图示的转化中发生的反应有 |
您最近一年使用:0次
名校
解题方法
5 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
(1)装置 中的装浓硝酸的仪器名称是
中的装浓硝酸的仪器名称是_____________________ ,仪器按气流方向连接顺序为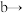
_____________________ 。
(2)①反应开始前打开止水夹 ,通入过量氮气的目的是
,通入过量氮气的目的是_________________________ 。
②反应结束后打开止水夹 ,再通入过量氮气的目的是
,再通入过量氮气的目的是_____________________ 。
(3)写出装置 中发生反应的离子方程式
中发生反应的离子方程式_________________________________________________________________ 。
(4)装置 能除去挥发的
能除去挥发的 蒸汽,另一作用是
蒸汽,另一作用是_________________________________________________ 。
(5)写出装置 中发生反应的离子方程式
中发生反应的离子方程式_________________________________________________________________ 。
 应用十分广泛,它是一种白色固体,外观与
应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
极其相似;少量可做食品的防腐剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。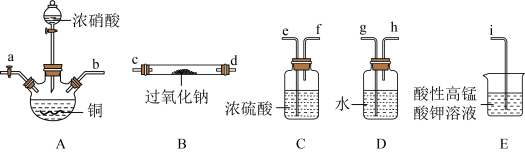
 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
(1)装置
 中的装浓硝酸的仪器名称是
中的装浓硝酸的仪器名称是
(2)①反应开始前打开止水夹
 ,通入过量氮气的目的是
,通入过量氮气的目的是②反应结束后打开止水夹
 ,再通入过量氮气的目的是
,再通入过量氮气的目的是(3)写出装置
 中发生反应的离子方程式
中发生反应的离子方程式(4)装置
 能除去挥发的
能除去挥发的 蒸汽,另一作用是
蒸汽,另一作用是(5)写出装置
 中发生反应的离子方程式
中发生反应的离子方程式
您最近一年使用:0次
名校
6 . 某研究小组利用下图所示装置探究卤素的性质。___________ (填“氧化性”或“还原性”)。
(2)①中溶液有I2生成,发生反应的化学方程式是___________ 。
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是___________ 。
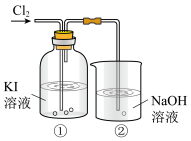
(2)①中溶液有I2生成,发生反应的化学方程式是
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是
您最近一年使用:0次
7 . 黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。____________ 。
(2)步骤④检验Fe3+所用试剂是_____________ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的阳离子 的离子符号为____________ 。
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______________ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______________ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
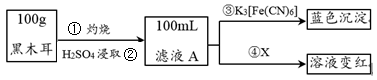
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
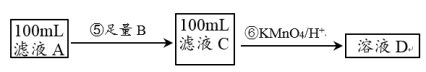
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近一年使用:0次
名校
8 . 含氮化合物在工农业有着重要的用途。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为____________ 。
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→______ (按气流方向,用小写字母表示)。
(3)请写出氨气的检验方法:____________ 。
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,____________ 。
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:______ —______ 。
Ⅱ. 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是____________ 。
(6)NO的检验方法是:____________ 。
Ⅲ.研究 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。
(7)选择性催化还原技术(SCR)可使 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:____________ 。
(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
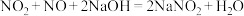 ;
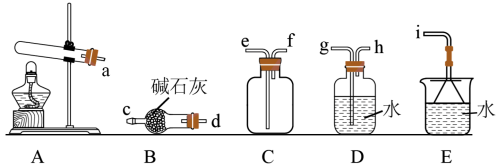
;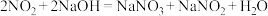 。
。
若33.6 mL(标况下)氮氧化物(只含NO和 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
______ 。
(1)氨气的发生装置可以选择上图中的A,反应的化学方程式为
(2)预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:a→
(3)请写出氨气的检验方法:
(4)甲、乙两同学分别设计了下图装备进行喷泉实验,
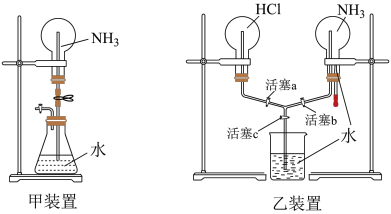
②乙同学想用乙装备在两个烧瓶同时产生喷泉,引发双喷泉的操作是:
Ⅱ.
 经一系列反应可以得到
经一系列反应可以得到 。
。
(5)①中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是(6)NO的检验方法是:
Ⅲ.研究
 、
、 、CO等大气污染气体的处理具有重要现实意义。
、CO等大气污染气体的处理具有重要现实意义。(7)选择性催化还原技术(SCR)可使
 与
与 直接反应,实现无害转化。当NO与
直接反应,实现无害转化。当NO与 的物质的量之比为2∶1时,写出发生反应的化学方程式:
的物质的量之比为2∶1时,写出发生反应的化学方程式:(8)大气污染物中的氮氧化物地可用NaOH吸收,先后发生如下反应:
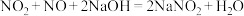 ;
;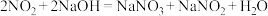 。
。若33.6 mL(标况下)氮氧化物(只含NO和
 )与V mL0.1 mol/L NaOH溶液恰好完全反应,则
)与V mL0.1 mol/L NaOH溶液恰好完全反应,则
您最近一年使用:0次
解题方法
9 . 碘化亚铁(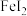 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)_______ ,若无此装置,写出铁粉参与的副反应的化学方程式:_______ ,硬质玻璃管中制备碘化亚铁的化学方程式为_______ 。
(2)硬质玻璃管直接接入收集器而不用导管的原因是_______ ,收集器浸泡在冷水中的原因是_______ 。
(3)试剂a的作用是_______ 。
(4)已知氧化性: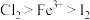 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:_______ 。
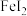 )在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收
)在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。实验室用下面装置制备碘化亚铁。(已知焦性没食子酸的碱性溶液可吸收 )
)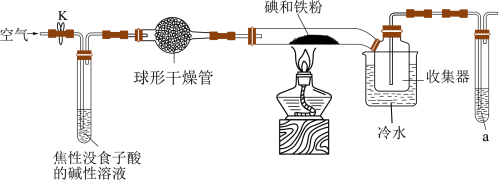
(2)硬质玻璃管直接接入收集器而不用导管的原因是
(3)试剂a的作用是
(4)已知氧化性:
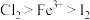 。往含
。往含 的溶液中通入
的溶液中通入 标准状况下的氯气,充分反应,请写出该反应的离子方程式:
标准状况下的氯气,充分反应,请写出该反应的离子方程式:
您最近一年使用:0次
10 . Ⅰ.某无色透明溶液中可能大量存在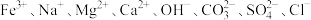 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
③向第三份溶液中先加入 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
已知: 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。
(1)根据上述实验现象可知,原溶液中一定存在的离子是_______ ,一定不存在的离子是_______ ,不能确定是否存在的离子是_______ 。
Ⅱ.次磷酸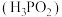 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。
(2)写出白磷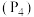 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:_______ ,反应中每消耗 ,转移的电子数为
,转移的电子数为_______ 。
(3)写出 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(4)工业上利用 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为_______ 。
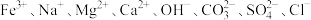 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量
 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;③向第三份溶液中先加入
 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。已知:
 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。(1)根据上述实验现象可知,原溶液中一定存在的离子是
Ⅱ.次磷酸
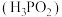 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。(2)写出白磷
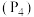 与
与 溶液反应的化学方程式:
溶液反应的化学方程式: ,转移的电子数为
,转移的电子数为(3)写出
 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(4)工业上利用
 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为
您最近一年使用:0次



