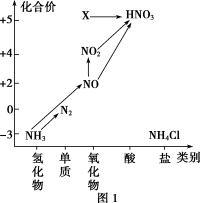
1 . 依据下图中氮元素及其化合物的转化关系,回答下列问题:_______ 。
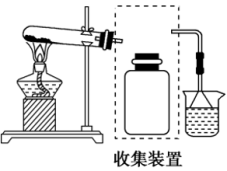
(2)若要收集一瓶氨,请将下列装置补充完整,在虚框内画出连接图_______ 。_______ 。
A.浓硫酸 B.碱石灰 C.NaOH固体
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO:化学方程式为_______ 。
②NO→NO2:实验现象是_______ 。
③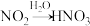 :氧化剂与还原剂的物质的量之比为
:氧化剂与还原剂的物质的量之比为_______ 。
(5)图1中,只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_______ 。
(6)图1中,X的化学式为_______ ,从物质性质上看,X属于_______ 氧化物。
(2)若要收集一瓶氨,请将下列装置补充完整,在虚框内画出连接图
A.浓硫酸 B.碱石灰 C.NaOH固体
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO:化学方程式为
②NO→NO2:实验现象是
③
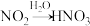 :氧化剂与还原剂的物质的量之比为
:氧化剂与还原剂的物质的量之比为(5)图1中,只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为
(6)图1中,X的化学式为
您最近一年使用:0次
名校
解题方法
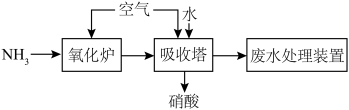
2 . I.氨催化氧化制硝酸的流程示意图如下。___________ 。
(2)“吸收塔”中生成硝酸的化学方程式为___________ 。(写出一个即可)
(3)为避免硝酸工业废气中 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:
①
②
现有一定条件下0.5mo1 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为___________ mol/L。
Ⅱ.研究炼油、钢铁等工业,上高浓度氨氮废水的处理,流程如下: 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式___________ 。
(5)过程②:在微生物的作用下实现 ,转化、称为硝化过程。硝化过程需加入的物质可以为
,转化、称为硝化过程。硝化过程需加入的物质可以为___________ 。(填相应的字母)
A. B.
B. C.
C.
(6)过程③:在一定条件下向废水中加入甲醇( ),实现
),实现 转化,称为反硝化过程。将含硝酸废水中的
转化,称为反硝化过程。将含硝酸废水中的 进行反硝化转化过程中,当收集到11.2L
进行反硝化转化过程中,当收集到11.2L  (标况)时,转移电子的总数为
(标况)时,转移电子的总数为___________ 。
(2)“吸收塔”中生成硝酸的化学方程式为
(3)为避免硝酸工业废气中
 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:①

②

现有一定条件下0.5mo1
 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为Ⅱ.研究炼油、钢铁等工业,上高浓度氨氮废水的处理,流程如下:

 与NaOH溶液反应的离子方程式
与NaOH溶液反应的离子方程式(5)过程②:在微生物的作用下实现
 ,转化、称为硝化过程。硝化过程需加入的物质可以为
,转化、称为硝化过程。硝化过程需加入的物质可以为A.
 B.
B. C.
C.
(6)过程③:在一定条件下向废水中加入甲醇(
 ),实现
),实现 转化,称为反硝化过程。将含硝酸废水中的
转化,称为反硝化过程。将含硝酸废水中的 进行反硝化转化过程中,当收集到11.2L
进行反硝化转化过程中,当收集到11.2L  (标况)时,转移电子的总数为
(标况)时,转移电子的总数为
您最近一年使用:0次
名校
解题方法
3 . 某课外活动小组在实验室制备氨气、验证氨气的某些性质。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是____ 。_____ 。
(3)B中试剂为___________ ,NaOH溶液的作用是___________ 。
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是___________ ,白烟的化学式是___________ 。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为___________ 。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是


(3)B中试剂为
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为
您最近一年使用:0次
名校
解题方法
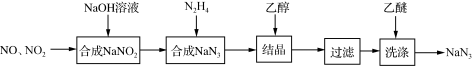
4 . 叠氮化钠(NaN3)是一种无色晶体,易溶于水,微溶于乙醇,不溶于乙醚,广泛应用于汽车安全气囊。某硝酸工厂拟通过下列方法处理尾气并制备叠氮化钠。___________ 。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为___________ ,1mol该阴离子中所含的电子总数为___________ mol
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
①该反应中的还原剂为___________ (填化学式)。
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克___________ ?(写出计算过程,保留一位小数,不考虑固体的体积)。
(2)已知NaN3阳离子与阴离子个数比为1:1,则NaN3中所含的化学键为
(3)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3
 K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。
K2O+5Na2O+16N2↑。假定汽车中某个安全气囊容积为56L。①该反应中的还原剂为
②欲使气囊中充满标准状况下氮气,则该安全气囊中生成的K2O和Na2O的总质量为多少克
您最近一年使用:0次
名校
5 . 下列化学方程式或离子方程式书写正确的是
A.氨的催化氧化: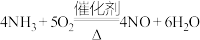 |
B.向 溶液中通入过量 溶液中通入过量 : : |
C.稀硝酸与过量的铁屑反应: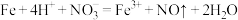 |
D.向碳酸氢铵溶液中加入足量石灰水: |
您最近一年使用:0次
名校
6 . 氯化亚铜(CuCl)难溶于醇和水,在潮湿空气中易水解氧化,广泛应用于冶金工业,以铜为原料生产 的流程如下:
的流程如下:错误 的是
 的流程如下:
的流程如下: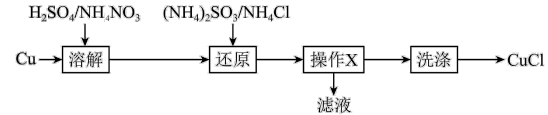
A.“溶解”时可能发生的反应: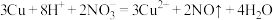 |
B.“还原”反应的氧化产物是 或 或 |
| C.“操作X”是过滤 |
| D.“洗涤”时先用硝酸洗,再用乙醇洗 |
您最近一年使用:0次
2024-03-14更新
|
523次组卷
|
4卷引用:陕西省西安市航天中学2023-2024学年高一下学期第一次月考化学试题
名校
7 . 海水中有丰富的资源。从海水中可以获得淡水、食盐,并提取溴。回答下列问题。
(1)初步提纯后的粗盐中含有 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
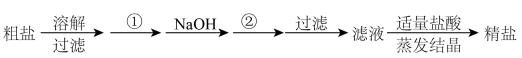
加入的试剂①、②分别是:___________ 、___________ 。
(2)工业上以晒盐后的卤水为原料进行提溴,主要流程如下:
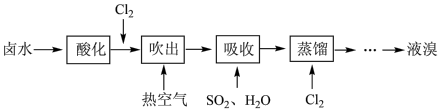
①卤水呈碱性,在通入 前需先酸化,原因是
前需先酸化,原因是___________ 。
②向酸化后的卤水中通入Cl2时主要发生反应的离子方程式为___________ 。
③“吹出”步骤中主要利用了溴的___________ 性。
④设立“吸收”步骤的目的是___________ 。
⑤吸收步骤中发生反应的化学方程式为___________ 。
⑥已知常压下 的沸点是59℃。蒸馏过程中,温度应控制在
的沸点是59℃。蒸馏过程中,温度应控制在___________ (填字母)范围内较合适。
a.20℃~30℃ B.45℃~55℃ C.75℃~85℃ D.100℃~110℃
⑦经该方法处理后, 海水最终得到
海水最终得到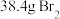 ,若总提取率为60%,则原海水中
,若总提取率为60%,则原海水中 的浓度是
的浓度是___________ 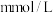 。
。
(1)初步提纯后的粗盐中含有
 、
、 、
、 等杂质,精制时一般步骤如下:
等杂质,精制时一般步骤如下:
加入的试剂①、②分别是:
(2)工业上以晒盐后的卤水为原料进行提溴,主要流程如下:

①卤水呈碱性,在通入
 前需先酸化,原因是
前需先酸化,原因是②向酸化后的卤水中通入Cl2时主要发生反应的离子方程式为
③“吹出”步骤中主要利用了溴的
④设立“吸收”步骤的目的是
⑤吸收步骤中发生反应的化学方程式为
⑥已知常压下
 的沸点是59℃。蒸馏过程中,温度应控制在
的沸点是59℃。蒸馏过程中,温度应控制在a.20℃~30℃ B.45℃~55℃ C.75℃~85℃ D.100℃~110℃
⑦经该方法处理后,
 海水最终得到
海水最终得到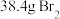 ,若总提取率为60%,则原海水中
,若总提取率为60%,则原海水中 的浓度是
的浓度是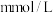 。
。
您最近一年使用:0次
名校
解题方法
8 . 氮是生命体重要的组成元素,自然界中氮的循环对生命活动有重要意义。
(1)汽车尾气主要含有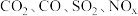 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的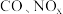 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为___________ 。
(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。___________ ;丙为钠盐,其化学式为__________ 。
②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为________ 。实验室用该反应原理制取并收集一瓶干燥的甲气体,从下图中选择合适的装置,其连接顺序为___________ 。(按从左到右的气流方向,用小写字母 和箭头表示)___________ (填字母)。
A. B.
B. C.
C. D.
D.
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与 按物质的量
按物质的量 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式___________ 。
(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。___________ 种价态。反应③和⑤中,若生成等物质的量的 ,则转移的电子数之比为
,则转移的电子数之比为___________ 。
(1)汽车尾气主要含有
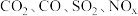 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的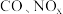 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。

②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为

A.
 B.
B. C.
C. D.
D.
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与
 按物质的量
按物质的量 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。
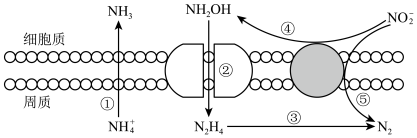
 ,则转移的电子数之比为
,则转移的电子数之比为
您最近一年使用:0次
2024-02-21更新
|
718次组卷
|
2卷引用:陕西省咸阳市实验中学2022-2023学年高一下学期第一次月考化学试题
名校
9 .  将逐渐取代
将逐渐取代 成为生产自来水的消毒剂。工业上常通过如下反应制取:
成为生产自来水的消毒剂。工业上常通过如下反应制取: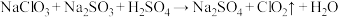 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是
 将逐渐取代
将逐渐取代 成为生产自来水的消毒剂。工业上常通过如下反应制取:
成为生产自来水的消毒剂。工业上常通过如下反应制取: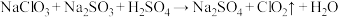 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是| A.反应中氯元素被氧化,硫元素被还原 |
B.还原性: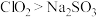 |
| C.氧化剂和还原剂的物质的量之比为2:1 |
D.每生成 转移2mol电子 转移2mol电子 |
您最近一年使用:0次
2024-02-11更新
|
160次组卷
|
4卷引用:陕西省宝鸡市金台区2023-2024学年高一上学期期末检测化学试题
名校
解题方法
10 . 锰元素能形成 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
已知:硫化氢 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。 溶液滴入
溶液滴入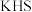 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为___________ 。
(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为___________ (填标号)。
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:___________ 。
(3)“打浆”:将所得 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是___________ 。
(4)“氧化”: 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为___________ 。
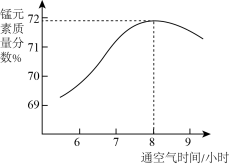
(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。___________ 。
 、
、 、
、 、
、 等多种氧化物,其中大颗粒
等多种氧化物,其中大颗粒 是重要的电池材料。工业上以碳酸锰矿(主要成分为
是重要的电池材料。工业上以碳酸锰矿(主要成分为 、
、 ,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为
,常温下二者皆为难溶于水的固体)和软锰矿(主要成分为 )为原料制取
)为原料制取 。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。
。其工艺主要包括“酸浸”“沉锰”“打浆”“氧化”。已知:硫化氢
 是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
是一种易燃、具有臭鸡蛋气味的有毒气体,有较强的还原性,溶于水得到氢硫酸溶液,是一种比碳酸还弱的酸。
 溶液滴入
溶液滴入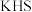 溶液中,发生反应的离子方程式为
溶液中,发生反应的离子方程式为(2)从安全及环保的角度来看“酸浸”过程中,向硫酸溶液中,加料方式为
A.先加软锰矿,再加碳酸锰矿 B.先加碳酸锰矿,再加软锰矿
过滤得到的“酸浸渣”中含有单质S,写出生成单质S的离子方程式:
(3)“打浆”:将所得
 制成悬浊液,可加快“氧化”反应速率的原因是
制成悬浊液,可加快“氧化”反应速率的原因是(4)“氧化”:
 置于空气中在60℃条件下加热即可得到
置于空气中在60℃条件下加热即可得到 ,该反应的化学方程为
,该反应的化学方程为(5)“氧化”所得固体产物中锰元素质量分数随通空气时间的变化如图所示。
您最近一年使用:0次
2023-12-13更新
|
233次组卷
|
3卷引用:陕西省西安市2023-2024学年高一下学期4月期中联考化学试题



