1 . 氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
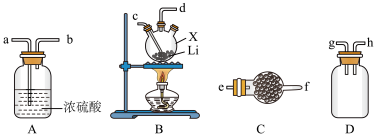
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为_______ (用小写字母和“→”表示),装置A的作用是_______ 。
(3)装置B中仪器X的名称是_______ ,装置C盛装的试剂是_______ 。实验开始后,向X中通入NH3与加热仪器X的先后顺序为_______ 。
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为_______ ,检验该气体产物的方法是_______ 。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
| A.浓氨水、CaO | B.NH4Cl固体、Ca(OH)2固体 |
| C.浓氨水 | D.NH4NO3固体、NaOH固体 |
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为
(3)装置B中仪器X的名称是
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为
您最近一年使用:0次
名校
2 . 工业利用闪锌矿(主要成分 ZnS,还含有FeS、 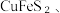 石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
已知:①酸性条件下,亚铜离子易发生歧化反应;② 易形成胶体;③碱性环境下
易形成胶体;③碱性环境下 以
以  形式存在。回答下列问题:
形式存在。回答下列问题:
(1)“浸出”前闪锌矿石要碾碎为粉末的原因是___________ 。
(2)“浸出”过程原理如图所示,ZnS“浸出”的总反应化学方程式为___________ 。
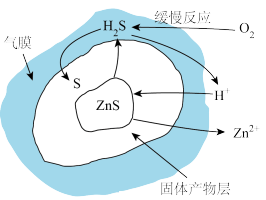
(3)“滤渣1”主要成分为S和___________ ;“加热加压氧化”发生反应的离子方程式为___________ 。
(4)“电积”时,F、Cl⁻会腐蚀电极板,需提前除净。
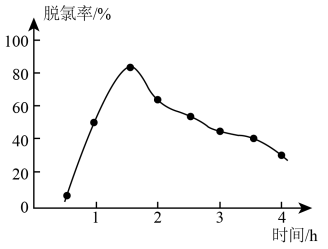
①“脱氯”时,脱氯率随时间变化如图所示,约1.5h后脱氯率减小的原因可能为___________ 。
②“脱氟时,先按物质的量之比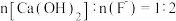 加入
加入  脱氟,充分反应后,
脱氟,充分反应后, 

___________ 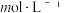 [已知
[已知  且不考虑
且不考虑  沉淀];后加入石灰石,目的为
沉淀];后加入石灰石,目的为___________ 。
(5)写出“电积”生成锌的电极反应式:___________ 。
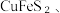 石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
已知:①酸性条件下,亚铜离子易发生歧化反应;②
 易形成胶体;③碱性环境下
易形成胶体;③碱性环境下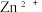 以
以  形式存在。回答下列问题:
形式存在。回答下列问题:(1)“浸出”前闪锌矿石要碾碎为粉末的原因是
(2)“浸出”过程原理如图所示,ZnS“浸出”的总反应化学方程式为

(3)“滤渣1”主要成分为S和
(4)“电积”时,F、Cl⁻会腐蚀电极板,需提前除净。
①“脱氯”时,脱氯率随时间变化如图所示,约1.5h后脱氯率减小的原因可能为

②“脱氟时,先按物质的量之比
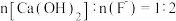 加入
加入  脱氟,充分反应后,
脱氟,充分反应后, 

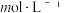 [已知
[已知  且不考虑
且不考虑  沉淀];后加入石灰石,目的为
沉淀];后加入石灰石,目的为(5)写出“电积”生成锌的电极反应式:
您最近一年使用:0次
名校
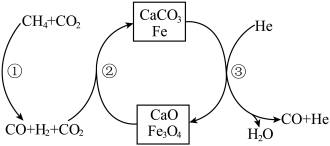
3 . 实现碳达峰、碳中和是党中央做出的重大战略决策。恒压、  时,
时, 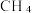 和
和 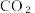 按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现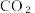 高效转化。下列说法正确的是
高效转化。下列说法正确的是
 时,
时, 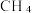 和
和 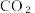 按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现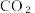 高效转化。下列说法正确的是
高效转化。下列说法正确的是
A.过程②中 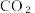 的吸收,不利于CO还原 的吸收,不利于CO还原  的平衡正向移动 的平衡正向移动 |
B.过程③中通入 He 的作用是催化剂,加快  分解 分解 |
| C.过程①、②、③均涉及到了氧化还原反应 |
D. 可循环利用,而 CaO不可循环利用 可循环利用,而 CaO不可循环利用 |
您最近一年使用:0次
4 . 下列指定反应的离子方程式正确的是
A.碳酸钡固体与醋酸反应: |
B.向碘化亚铁溶液中加入足量溴水: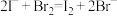 |
C.Cu与稀硝酸反应: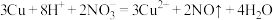 |
D.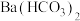 溶液中加入少量NaOH溶液: 溶液中加入少量NaOH溶液: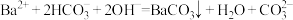 |
您最近一年使用:0次
2023-12-22更新
|
272次组卷
|
2卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
名校
解题方法
5 . 钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂.利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
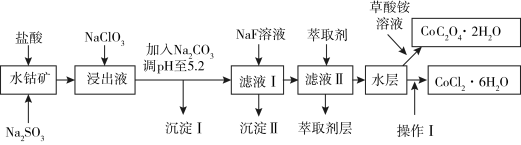
已知:① 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为加快钴矿“浸出”效率,可采取的措施是______ (任选一条),浸出过程中加入的 与
与 反应的离子方程式为
反应的离子方程式为______ .
(2)加入 的作用是
的作用是______ ,后续加入 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是______ .
(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中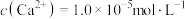 ,则:
,则: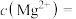
______  .[已知:
.[已知: ,
, ]
]
(4)加入萃取剂可以除去的杂质离子是______ .
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,______ 、过滤、洗涤、减压烘干等过程.
(6)在空气中加热5.49g草酸钴晶体( ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]
经测定,210~290℃过程中产生的气体只有 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是______ .
 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
已知:①
 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物 |
|
|
|
|
|
开始沉淀 | 27 | 7.6 | 7.6 | 4.0 | 7.7 |
沉淀完全 | 3.7 | 9.6 | 9.2 | 5.1 | 9.8 |
(1)为加快钴矿“浸出”效率,可采取的措施是
 与
与 反应的离子方程式为
反应的离子方程式为(2)加入
 的作用是
的作用是 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中
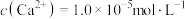 ,则:
,则: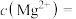
 .[已知:
.[已知: ,
, ]
](4)加入萃取剂可以除去的杂质离子是
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,
(6)在空气中加热5.49g草酸钴晶体(
 ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/g | 4.41 | 2.41 | 2.25 |
 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是
您最近一年使用:0次
2023-12-21更新
|
393次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
6 . 大力推广锂电池新能源汽车对实现“碳达峰”“碳中和”具有重要意义. 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下: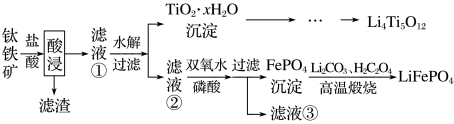
A.酸浸后,得到滤渣的主要成分是 |
B.在滤液②中主要的金属阳离子有 、 、 |
C.高温煅烧时发生的反应为 |
D.制备 过程中会生成 过程中会生成 (Ti为+4价),则 (Ti为+4价),则 中不含过氧键 中不含过氧键 |
您最近一年使用:0次
2023-12-21更新
|
604次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题陕西省汉中市2023-2024学年高三上学期教学质量第一次检测(一模)化学试卷(已下线)化学(九省联考考后提升卷,吉林、黑龙江卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)
7 . 中科院研究成果“无细胞化学酶系统催化CO2合成淀粉[(C6H10O5)n]”在国际学术期刊《自然》上发表,引发化学界极大关注。部分核心反应转化如图所示,下列叙述正确的是


A.反应Ⅰ中,反应物的物质的量之比为 |
B.反应Ⅲ需要额外从环境中补充 |
C.反应Ⅱ用到的“ ”和Ⅲ用到的 ”和Ⅲ用到的 均为对应反应的催化剂 均为对应反应的催化剂 |
D. 转化为淀粉的原子利用率可达100% 转化为淀粉的原子利用率可达100% |
您最近一年使用:0次
2023-11-04更新
|
204次组卷
|
2卷引用:陕西省汉中中学2023-2024学年高三上学期11月质量检测化学试题
解题方法
8 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
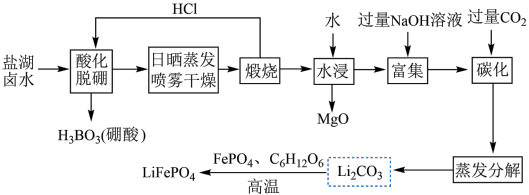
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
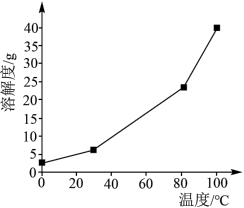
已知: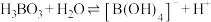
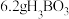 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
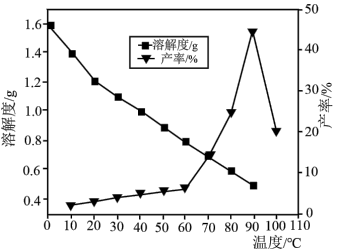
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
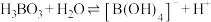
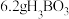 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
9 . 高纯度硫酸锰是制作锂电池正极的主要原料之一,随着新能源车的兴起,对高纯度硫酸锰的需求量越来越大。一种以钨冶炼渣(主要成分为 、
、 ,还含有
,还含有 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯硫酸锰的工艺流程如图:
等杂质)为原料制备高纯硫酸锰的工艺流程如图:

已知:①当温度低于25℃时,硫酸锰的溶解度随温度的升高而增大;当温度高于25℃时,硫酸锰的溶解度随温度的升高而减小。
②金属离子在水溶液中形成沉淀的 范围如表所示(25℃):
范围如表所示(25℃):
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 价;“浸出”时搅拌的目的是___________ 。
(2)在实验室进行分离出“废渣1”的操作时需要的玻璃仪器有___________ 。
(3)通常“氧化”时加入的 是过量的,分析可能原因:
是过量的,分析可能原因:___________ (写一条)
(4)“调 除杂”的目的是除去
除杂”的目的是除去 、
、 元素,则调节溶液的
元素,则调节溶液的 的最佳范围为
的最佳范围为___________ 。
(5)“氟化除杂”后,测得溶液中 为
为 ,则溶液中
,则溶液中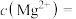
___________  。[已知:
。[已知: ;
; ]
]
(6)“酸溶”时发生反应的化学方程式为___________ ,“系列操作”的具体步骤为___________ 、洗涤、干燥。
 、
、 ,还含有
,还含有 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯硫酸锰的工艺流程如图:
等杂质)为原料制备高纯硫酸锰的工艺流程如图:
已知:①当温度低于25℃时,硫酸锰的溶解度随温度的升高而增大;当温度高于25℃时,硫酸锰的溶解度随温度的升高而减小。
②金属离子在水溶液中形成沉淀的
 范围如表所示(25℃):
范围如表所示(25℃):| 物质 |  |  |  |  |
开始沉淀的 | 1.9 | 7.6 | 7.3 | 3.0 |
完全沉淀的 | 3.2 | 9.6 | 9.3 | 5.2 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)在实验室进行分离出“废渣1”的操作时需要的玻璃仪器有
(3)通常“氧化”时加入的
 是过量的,分析可能原因:
是过量的,分析可能原因:(4)“调
 除杂”的目的是除去
除杂”的目的是除去 、
、 元素,则调节溶液的
元素,则调节溶液的 的最佳范围为
的最佳范围为(5)“氟化除杂”后,测得溶液中
 为
为 ,则溶液中
,则溶液中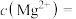
 。[已知:
。[已知: ;
; ]
](6)“酸溶”时发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
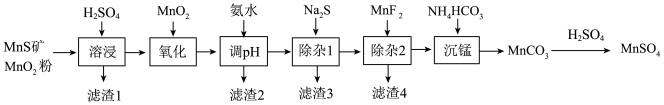
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)为了加快溶浸效果,可采取的措施有_______ (任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______ 。
(3)滤渣2除了含有Al(OH)3还含有_______ 。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(5)写出“沉锰”的离子方程式_______ 。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式
(3)滤渣2除了含有Al(OH)3还含有
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)写出“沉锰”的离子方程式
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2023-08-27更新
|
211次组卷
|
3卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题








