名校
解题方法
1 . 工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: 难溶于水;
难溶于水;
②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1) 中Cu的化合价为
中Cu的化合价为___________ ,酸浸过程中, 反应的离子方程式
反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择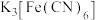 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)氧化后,从反应体系中分离出 粗产品的操作名称是
粗产品的操作名称是___________ 。
(4)上述流程中,基态原子未成对电子数最多的金属元素名称是___________ 。
(5)向 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式___________ 。
(6)已知常温下, ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=___________ 。
 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备
等杂质)为原料制备 (铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下:
(铋酸钠,浅黄色不溶于冷水的固体,是常用试剂),流程如下: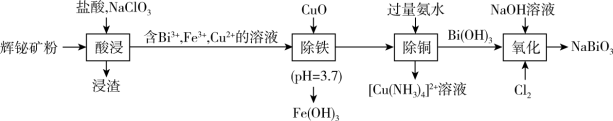
 难溶于水;
难溶于水;②酸浸后,矿粉中的硫元素完全变为硫单质;
回答下列问题:
(1)
 中Cu的化合价为
中Cu的化合价为 反应的离子方程式
反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择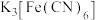 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)氧化后,从反应体系中分离出
 粗产品的操作名称是
粗产品的操作名称是(4)上述流程中,基态原子未成对电子数最多的金属元素名称是
(5)向
 和
和 混合溶液中通入氯气制备
混合溶液中通入氯气制备 的离子方程式
的离子方程式(6)已知常温下,
 ,调节FeCl3溶液至
,调节FeCl3溶液至 ,所得溶液中c(Fe3+)=
,所得溶液中c(Fe3+)=
您最近半年使用:0次
2 . 氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
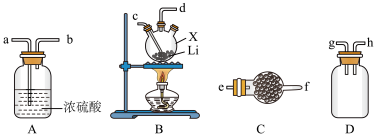
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为_______ (用小写字母和“→”表示),装置A的作用是_______ 。
(3)装置B中仪器X的名称是_______ ,装置C盛装的试剂是_______ 。实验开始后,向X中通入NH3与加热仪器X的先后顺序为_______ 。
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为_______ ,检验该气体产物的方法是_______ 。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
| A.浓氨水、CaO | B.NH4Cl固体、Ca(OH)2固体 |
| C.浓氨水 | D.NH4NO3固体、NaOH固体 |
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为
(3)装置B中仪器X的名称是
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为
您最近半年使用:0次
名校
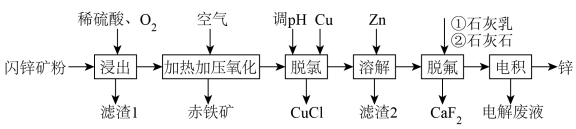
3 . 工业利用闪锌矿(主要成分 ZnS,还含有FeS、 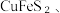 石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
已知:①酸性条件下,亚铜离子易发生歧化反应;② 易形成胶体;③碱性环境下
易形成胶体;③碱性环境下 以
以  形式存在。回答下列问题:
形式存在。回答下列问题:
(1)“浸出”前闪锌矿石要碾碎为粉末的原因是___________ 。
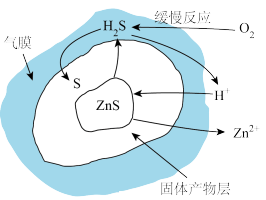
(2)“浸出”过程原理如图所示,ZnS“浸出”的总反应化学方程式为___________ 。
(3)“滤渣1”主要成分为S和___________ ;“加热加压氧化”发生反应的离子方程式为___________ 。
(4)“电积”时,F、Cl⁻会腐蚀电极板,需提前除净。
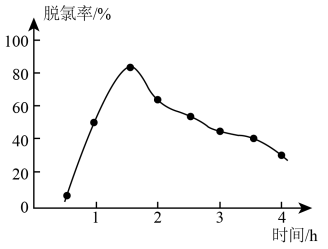
①“脱氯”时,脱氯率随时间变化如图所示,约1.5h后脱氯率减小的原因可能为___________ 。
②“脱氟时,先按物质的量之比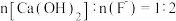 加入
加入  脱氟,充分反应后,
脱氟,充分反应后, 

___________ 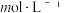 [已知
[已知  且不考虑
且不考虑  沉淀];后加入石灰石,目的为
沉淀];后加入石灰石,目的为___________ 。
(5)写出“电积”生成锌的电极反应式:___________ 。
 石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
石英及F-、Cl⁻等杂质)富氧酸浸提取锌,同时实现环保除铁的工艺流程如下:
已知:①酸性条件下,亚铜离子易发生歧化反应;②
 易形成胶体;③碱性环境下
易形成胶体;③碱性环境下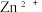 以
以  形式存在。回答下列问题:
形式存在。回答下列问题:(1)“浸出”前闪锌矿石要碾碎为粉末的原因是
(2)“浸出”过程原理如图所示,ZnS“浸出”的总反应化学方程式为

(3)“滤渣1”主要成分为S和
(4)“电积”时,F、Cl⁻会腐蚀电极板,需提前除净。
①“脱氯”时,脱氯率随时间变化如图所示,约1.5h后脱氯率减小的原因可能为

②“脱氟时,先按物质的量之比
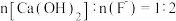 加入
加入  脱氟,充分反应后,
脱氟,充分反应后, 

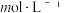 [已知
[已知  且不考虑
且不考虑  沉淀];后加入石灰石,目的为
沉淀];后加入石灰石,目的为(5)写出“电积”生成锌的电极反应式:
您最近半年使用:0次
名校
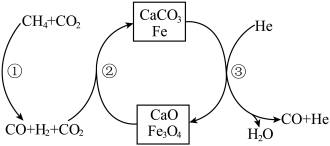
4 . 实现碳达峰、碳中和是党中央做出的重大战略决策。恒压、  时,
时, 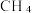 和
和 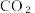 按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现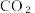 高效转化。下列说法正确的是
高效转化。下列说法正确的是
 时,
时, 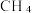 和
和 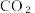 按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现
按物质的量之比1:3 投料,反应经如下流程(主要产物已标出)可实现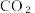 高效转化。下列说法正确的是
高效转化。下列说法正确的是
A.过程②中 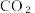 的吸收,不利于CO还原 的吸收,不利于CO还原  的平衡正向移动 的平衡正向移动 |
B.过程③中通入 He 的作用是催化剂,加快  分解 分解 |
| C.过程①、②、③均涉及到了氧化还原反应 |
D. 可循环利用,而 CaO不可循环利用 可循环利用,而 CaO不可循环利用 |
您最近半年使用:0次
5 . 下列指定反应的离子方程式正确的是
A.碳酸钡固体与醋酸反应: |
B.向碘化亚铁溶液中加入足量溴水: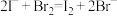 |
C.Cu与稀硝酸反应: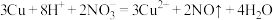 |
D.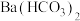 溶液中加入少量NaOH溶液: 溶液中加入少量NaOH溶液: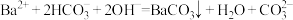 |
您最近半年使用:0次
2023-12-22更新
|
270次组卷
|
2卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
名校
解题方法
6 . 钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂.利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
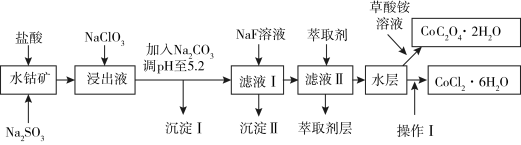
已知:① 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为加快钴矿“浸出”效率,可采取的措施是______ (任选一条),浸出过程中加入的 与
与 反应的离子方程式为
反应的离子方程式为______ .
(2)加入 的作用是
的作用是______ ,后续加入 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是______ .
(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中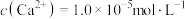 ,则:
,则: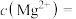
______  .[已知:
.[已知: ,
, ]
]
(4)加入萃取剂可以除去的杂质离子是______ .
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,______ 、过滤、洗涤、减压烘干等过程.
(6)在空气中加热5.49g草酸钴晶体( ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]
经测定,210~290℃过程中产生的气体只有 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是______ .
 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
已知:①
 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物 |
|
|
|
|
|
开始沉淀 | 27 | 7.6 | 7.6 | 4.0 | 7.7 |
沉淀完全 | 3.7 | 9.6 | 9.2 | 5.1 | 9.8 |
(1)为加快钴矿“浸出”效率,可采取的措施是
 与
与 反应的离子方程式为
反应的离子方程式为(2)加入
 的作用是
的作用是 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中
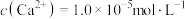 ,则:
,则: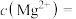
 .[已知:
.[已知: ,
, ]
](4)加入萃取剂可以除去的杂质离子是
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,
(6)在空气中加热5.49g草酸钴晶体(
 ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/g | 4.41 | 2.41 | 2.25 |
 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是
您最近半年使用:0次
2023-12-21更新
|
384次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
7 . 大力推广锂电池新能源汽车对实现“碳达峰”“碳中和”具有重要意义. 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下: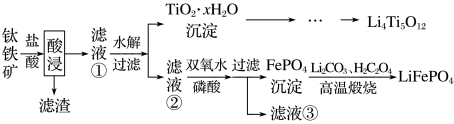
A.酸浸后,得到滤渣的主要成分是 |
B.在滤液②中主要的金属阳离子有 、 、 |
C.高温煅烧时发生的反应为 |
D.制备 过程中会生成 过程中会生成 (Ti为+4价),则 (Ti为+4价),则 中不含过氧键 中不含过氧键 |
您最近半年使用:0次
2023-12-21更新
|
584次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题陕西省汉中市2023-2024学年高三上学期教学质量第一次检测(一模)化学试卷(已下线)化学(九省联考考后提升卷,吉林、黑龙江卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)
8 . 已知反应:①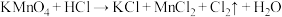
② 、
、
③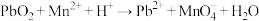 (方程式均未配平)。
(方程式均未配平)。
下列说法不正确的是
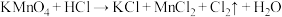
②
 、
、③
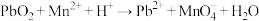 (方程式均未配平)。
(方程式均未配平)。下列说法不正确的是
A.反应③中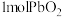 参加反应转移电子2mol 参加反应转移电子2mol |
B.反应①中氧化剂与参与反应的HCl的物质的量之比为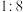 |
C.上述反应中,还原性由强到弱顺序: 、 、 、 、 |
D.反应①和②中消耗相同物质的量的 和 和 时,生成 时,生成 的物质的量之比为 的物质的量之比为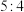 |
您最近半年使用:0次
解题方法
9 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。如图为氯元素的“价—类”二维图。
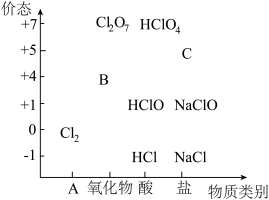
请回答下列问题:
(1)二维图中类别 A 是_______ ; B 可以代替(  2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是_______ (填化学式,下同);C的焰色试验呈紫色,则C是_______ 。
(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与_______ (填序号)发生反应;从化合价角度看,盐酸中 Cl⁻具有_______ 性,可能与_______ (填序号)发生反应。
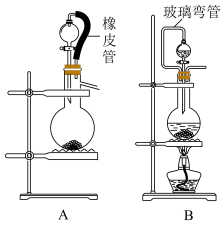
(3)实验室常用 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的_______ (填“A”或“B”)作为发生装置,反应的离子方程式为_______ 。
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为: 2
2 2
2 2
2 2
2 。
。
①该反应说明氧化性:NaClO_______ O2(填“>”、“<”或“=”)。
②用单线桥法表示该反应电子转移的方向和数目:_______ 。
(5)一定温度下, 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为_______ 。

请回答下列问题:
(1)二维图中类别 A 是
 2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
(3)实验室常用
 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为:
 2
2 2
2 2
2 2
2 。
。①该反应说明氧化性:NaClO
②用单线桥法表示该反应电子转移的方向和数目:
(5)一定温度下,
 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为
您最近半年使用:0次
10 . 中科院研究成果“无细胞化学酶系统催化CO2合成淀粉[(C6H10O5)n]”在国际学术期刊《自然》上发表,引发化学界极大关注。部分核心反应转化如图所示,下列叙述正确的是


A.反应Ⅰ中,反应物的物质的量之比为 |
B.反应Ⅲ需要额外从环境中补充 |
C.反应Ⅱ用到的“ ”和Ⅲ用到的 ”和Ⅲ用到的 均为对应反应的催化剂 均为对应反应的催化剂 |
D. 转化为淀粉的原子利用率可达100% 转化为淀粉的原子利用率可达100% |
您最近半年使用:0次
2023-11-04更新
|
204次组卷
|
2卷引用:陕西省汉中中学2023-2024学年高三上学期11月质量检测化学试题








