1 . 氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390℃,沸点是430℃,溶于冷水,遇热水则强烈水解。在380~400℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
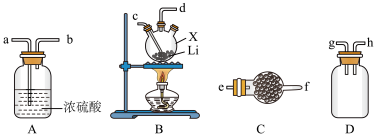
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为_______ (用小写字母和“→”表示),装置A的作用是_______ 。
(3)装置B中仪器X的名称是_______ ,装置C盛装的试剂是_______ 。实验开始后,向X中通入NH3与加热仪器X的先后顺序为_______ 。
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为_______ ,检验该气体产物的方法是_______ 。

(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是_______(填字母)。
| A.浓氨水、CaO | B.NH4Cl固体、Ca(OH)2固体 |
| C.浓氨水 | D.NH4NO3固体、NaOH固体 |
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为
(3)装置B中仪器X的名称是
(4)氨基锂与热水反应生成一种碱和一种气体,其化学方程式为
您最近一年使用:0次
2 . 下列指定反应的离子方程式正确的是
A.碳酸钡固体与醋酸反应: |
B.向碘化亚铁溶液中加入足量溴水: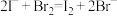 |
C.Cu与稀硝酸反应: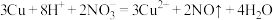 |
D.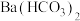 溶液中加入少量NaOH溶液: 溶液中加入少量NaOH溶液: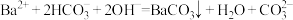 |
您最近一年使用:0次
2023-12-22更新
|
272次组卷
|
2卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
名校
解题方法
3 . 钴在现代有着广泛应用,如草酸钴可作指示剂与催化剂,氯化钴是一种饲料营养强化剂.利用水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
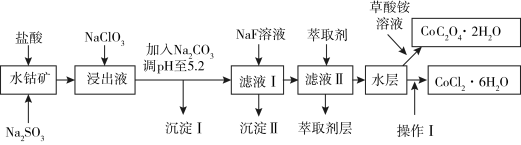
已知:① 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)为加快钴矿“浸出”效率,可采取的措施是______ (任选一条),浸出过程中加入的 与
与 反应的离子方程式为
反应的离子方程式为______ .
(2)加入 的作用是
的作用是______ ,后续加入 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是______ .
(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中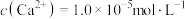 ,则:
,则: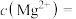
______  .[已知:
.[已知: ,
, ]
]
(4)加入萃取剂可以除去的杂质离子是______ .
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,______ 、过滤、洗涤、减压烘干等过程.
(6)在空气中加热5.49g草酸钴晶体( ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]
经测定,210~290℃过程中产生的气体只有 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是______ .
 ,含少量
,含少量 、
、 、
、 、MgO、CaO、
、MgO、CaO、 等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
等)可以制取草酸钴晶体和氯化钴晶体,依据以下制备流程回答下列问题:
已知:①
 具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
具有强氧化性.②沉淀Ⅰ中只含有两种沉淀.③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物 |
|
|
|
|
|
开始沉淀 | 27 | 7.6 | 7.6 | 4.0 | 7.7 |
沉淀完全 | 3.7 | 9.6 | 9.2 | 5.1 | 9.8 |
(1)为加快钴矿“浸出”效率,可采取的措施是
 与
与 反应的离子方程式为
反应的离子方程式为(2)加入
 的作用是
的作用是 调pH得到沉淀Ⅰ的成分是
调pH得到沉淀Ⅰ的成分是(3)NaF溶液可将钙、镁离子转化为沉淀过滤除去,若所得滤液中
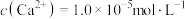 ,则:
,则: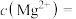
 .[已知:
.[已知: ,
, ]
](4)加入萃取剂可以除去的杂质离子是
(5)操作Ⅰ包括:向水层加入浓盐酸调整pH为2~3,
(6)在空气中加热5.49g草酸钴晶体(
 ),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知:
),受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:[已知: ]
]温度范围/℃ | 150~210 | 290~320 | 890~920 |
固体质量/g | 4.41 | 2.41 | 2.25 |
 ,此过程发生反应的化学方程式是
,此过程发生反应的化学方程式是
您最近一年使用:0次
2023-12-21更新
|
393次组卷
|
4卷引用:陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
4 . 已知反应:①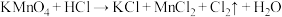
② 、
、
③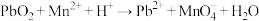 (方程式均未配平)。
(方程式均未配平)。
下列说法不正确的是
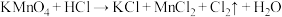
②
 、
、③
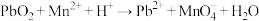 (方程式均未配平)。
(方程式均未配平)。下列说法不正确的是
A.反应③中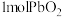 参加反应转移电子2mol 参加反应转移电子2mol |
B.反应①中氧化剂与参与反应的HCl的物质的量之比为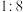 |
C.上述反应中,还原性由强到弱顺序: 、 、 、 、 |
D.反应①和②中消耗相同物质的量的 和 和 时,生成 时,生成 的物质的量之比为 的物质的量之比为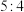 |
您最近一年使用:0次
解题方法
5 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。如图为氯元素的“价—类”二维图。
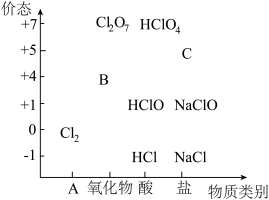
请回答下列问题:
(1)二维图中类别 A 是_______ ; B 可以代替(  2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是_______ (填化学式,下同);C的焰色试验呈紫色,则C是_______ 。
(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与_______ (填序号)发生反应;从化合价角度看,盐酸中 Cl⁻具有_______ 性,可能与_______ (填序号)发生反应。
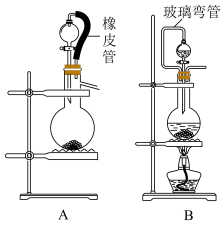
(3)实验室常用 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的_______ (填“A”或“B”)作为发生装置,反应的离子方程式为_______ 。
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为: 2
2 2
2 2
2 2
2 。
。
①该反应说明氧化性:NaClO_______ O2(填“>”、“<”或“=”)。
②用单线桥法表示该反应电子转移的方向和数目:_______ 。
(5)一定温度下, 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为_______ 。

请回答下列问题:
(1)二维图中类别 A 是
 2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
(3)实验室常用
 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为:
 2
2 2
2 2
2 2
2 。
。①该反应说明氧化性:NaClO
②用单线桥法表示该反应电子转移的方向和数目:
(5)一定温度下,
 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为
您最近一年使用:0次
6 . 中科院研究成果“无细胞化学酶系统催化CO2合成淀粉[(C6H10O5)n]”在国际学术期刊《自然》上发表,引发化学界极大关注。部分核心反应转化如图所示,下列叙述正确的是


A.反应Ⅰ中,反应物的物质的量之比为 |
B.反应Ⅲ需要额外从环境中补充 |
C.反应Ⅱ用到的“ ”和Ⅲ用到的 ”和Ⅲ用到的 均为对应反应的催化剂 均为对应反应的催化剂 |
D. 转化为淀粉的原子利用率可达100% 转化为淀粉的原子利用率可达100% |
您最近一年使用:0次
2023-11-04更新
|
204次组卷
|
2卷引用:陕西省汉中中学2023-2024学年高三上学期11月质量检测化学试题
解题方法
7 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
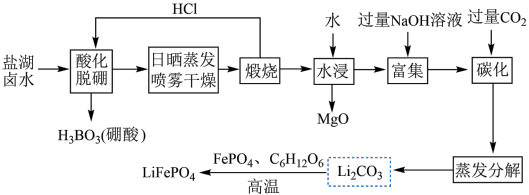
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
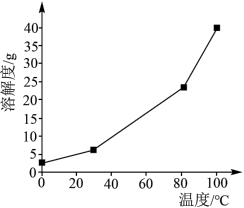
已知: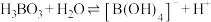
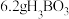 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
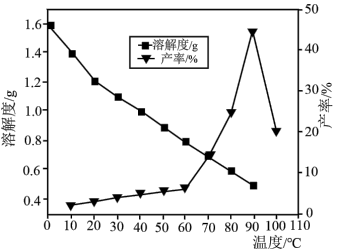
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
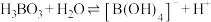
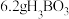 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
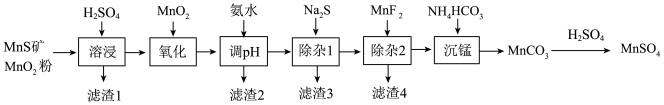
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)为了加快溶浸效果,可采取的措施有_______ (任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______ 。
(3)滤渣2除了含有Al(OH)3还含有_______ 。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(5)写出“沉锰”的离子方程式_______ 。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式
(3)滤渣2除了含有Al(OH)3还含有
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)写出“沉锰”的离子方程式
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2023-08-27更新
|
211次组卷
|
3卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题
解题方法
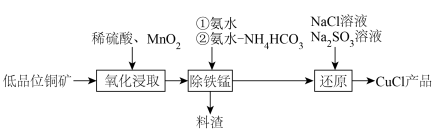
9 . 氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
已知:①室温下,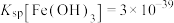 ;
;
②CuCl易被 氧化且在溶液中易与
氧化且在溶液中易与 形成可溶的
形成可溶的 。
。
回答下列问题:
(1)“氧化浸取”时,铜元素全部转化为 ,铁元素全部转化为
,铁元素全部转化为 。
。
① 、
、 和稀硫酸反应生成
和稀硫酸反应生成 ,
, 和S的离子方程式为
和S的离子方程式为___________ 。
②为提高铜元素的浸出率,工艺上可采取的措施有___________ (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量 C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、再用氨水— 混合溶液沉锰。
混合溶液沉锰。
①室温下,用氨水调节溶液的pH为3时, 为
为___________  。
。
②向除铁后的溶液中滴加氨水— 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为___________ 。
(3)①“还原”时,反应生成CuCl的离子方程式为___________ ;如图1所示, 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是___________ 。

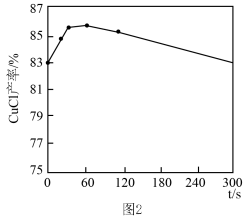
②如图2所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是___________ 。
 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
已知:①室温下,
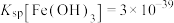 ;
;②CuCl易被
 氧化且在溶液中易与
氧化且在溶液中易与 形成可溶的
形成可溶的 。
。回答下列问题:
(1)“氧化浸取”时,铜元素全部转化为
 ,铁元素全部转化为
,铁元素全部转化为 。
。①
 、
、 和稀硫酸反应生成
和稀硫酸反应生成 ,
, 和S的离子方程式为
和S的离子方程式为②为提高铜元素的浸出率,工艺上可采取的措施有
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量 C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、再用氨水—
 混合溶液沉锰。
混合溶液沉锰。①室温下,用氨水调节溶液的pH为3时,
 为
为 。
。②向除铁后的溶液中滴加氨水—
 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为(3)①“还原”时,反应生成CuCl的离子方程式为
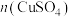 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是
②如图2所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是

您最近一年使用:0次
2023-07-16更新
|
256次组卷
|
2卷引用:2024届陕西省汉中市汉台区高三下学期教学质量检测(一模)理综试题-高中化学
10 . “绿水青山就是金山银山”是重要的发展理念,研究 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。
(1)钙基固硫技术可减少 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应①:
反应②:
反应③:
___________ (填含 、
、 的代数式)。
的代数式)。
(2) 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。
①有人利用尿素水溶液热解产生的 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;

a.尿素 中氮元素的化合价为
中氮元素的化合价为___________ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:___________ 。
②某种脱硝反应机理如图2所示, 参与的反应
参与的反应 的方程式为
的方程式为___________ 。

③实验室模拟汽车尾气转化器中的反应 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入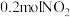 和
和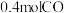 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为___________ 。
④一定条件下,反应 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第___________ 步是决速步骤。在恒温恒容密闭容器中进行上述反应,原料组成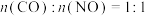 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。

 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。(1)钙基固硫技术可减少
 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:反应①:

反应②:

反应③:

 、
、 的代数式)。
的代数式)。(2)
 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。①有人利用尿素水溶液热解产生的
 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:②某种脱硝反应机理如图2所示,
 参与的反应
参与的反应 的方程式为
的方程式为
③实验室模拟汽车尾气转化器中的反应
 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入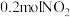 和
和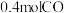 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为④一定条件下,反应
 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第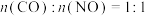 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2023-07-06更新
|
97次组卷
|
2卷引用:陕西省汉中市2022-2023学年高二下学期期末联考化学试题








