2024·陕西榆林·三模
名校
1 .  (三氯化六氨合钴,
(三氯化六氨合钴,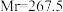 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入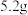 研细的
研细的 、
、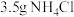 和
和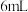 水,加热溶解后加入
水,加热溶解后加入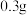 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入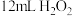 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,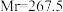 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;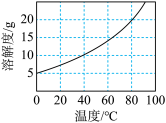
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入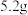 研细的
研细的 、
、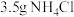 和
和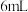 水,加热溶解后加入
水,加热溶解后加入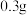 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
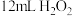 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
解题方法
2 .  具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、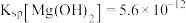 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:___________ ;加入 的目的是
的目的是___________ 。
(2)滤渣1的主要成分为___________ 、___________ 及不溶于酸、碱的杂质;加入 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
___________ 。
(3)若通入过量 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为___________ 。
(4)写出洗去固体A表面杂质的简要操作:___________ 。
(5)“煅烧”固体A反应的化学方程式为___________ 。
 具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为
具有耐高温的惰性,高活性,可广泛应用于制作各种塑料、橡胶、陶瓷、耐火材料等。工业上以油页岩灰渣(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 和其他不溶于酸、碱的杂质)为原料制备纳米
和其他不溶于酸、碱的杂质)为原料制备纳米 的流程如下。已知:
的流程如下。已知: 熔点高,硬度大,不溶于酸、碱;常温下,
熔点高,硬度大,不溶于酸、碱;常温下, 、
、 、
、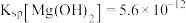 ;溶液中离子的浓度小于
;溶液中离子的浓度小于 时可视为该离子沉淀完全。请回答下列问题:
时可视为该离子沉淀完全。请回答下列问题:
 的目的是
的目的是(2)滤渣1的主要成分为
 调节溶液的
调节溶液的 为13后,溶液中的
为13后,溶液中的
(3)若通入过量
 ,发生的主要反应的离子方程式为
,发生的主要反应的离子方程式为(4)写出洗去固体A表面杂质的简要操作:
(5)“煅烧”固体A反应的化学方程式为
您最近一年使用:0次
2024-04-25更新
|
180次组卷
|
3卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
3 .  是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
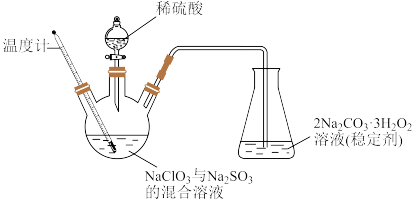
(1)盛装稀硫酸的仪器名称为___________ ;控制温度为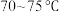 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为___________ ;写出生成 反应的化学方程式:
反应的化学方程式:___________ 。
(2)长导管的作用为___________ 。
(3)使用过碳酸钠( ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)稳定液中的 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。
①请分析盐酸活化效果最好的原因:___________ 。
②使用盐酸作活化剂时发生反应的离子方程式为___________ 。
 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
(1)盛装稀硫酸的仪器名称为
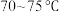 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为 反应的化学方程式:
反应的化学方程式:(2)长导管的作用为
(3)使用过碳酸钠(
 ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:(4)稳定液中的
 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。活化剂用量 活化率 活化剂 | 5mL | 10mL | 15mL | 20mL | 25mL |
盐酸 | 29.32% | 58.02% | 86.91% | 99.57% | 100.00% |
醋酸 | 26.75% | 55.52% | 79.01% | 97.22% | 97.53% |
柠檬酸 | 20.03% | 41.22% | 52.13% | 53.76% | 59.80% |
②使用盐酸作活化剂时发生反应的离子方程式为
您最近一年使用:0次
2024-03-31更新
|
113次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
解题方法
4 . 一种锂离子电池的正极材料中含钴酸锂( )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、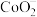 、
、 、
、 等微粒,溶液中
等微粒,溶液中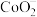 、
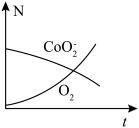
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
 )。某离子反应涉及
)。某离子反应涉及 、
、 、
、 、
、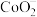 、
、 、
、 等微粒,溶液中
等微粒,溶液中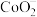 、
、 的粒子数目随时间变化的曲线如图所示。下列说法错误的是
的粒子数目随时间变化的曲线如图所示。下列说法错误的是
A.反应中的还原剂是 |
B.氧化性: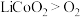 |
| C.反应配平后氧化剂与还原剂的化学计量数之比为2:1 |
D.每生成2分子 转移8个电子 转移8个电子 |
您最近一年使用:0次
解题方法
5 . 羰基硫( ,沸点:
,沸点: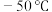 )又称氧硫化碳,其结构与
)又称氧硫化碳,其结构与 类似.回答下列问题:
类似.回答下列问题:
(1)实验室中通常用粉状硫氰化钾、水和浓硫酸反应制备 ,同时生成两种硫酸氢盐。写出该反应的化学方程式:
,同时生成两种硫酸氢盐。写出该反应的化学方程式:__________________________________ .
(2)以 为原料制备其他含硫物质的流程如下(部分产物已略去):
为原料制备其他含硫物质的流程如下(部分产物已略去):
 溶液
溶液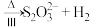
①反应Ⅰ中另一种产物是_____________ 。
②写出反应Ⅲ的离子方程式:_____________________________________________ 。
(3) 和
和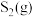 反应是制备
反应是制备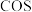 的另一种方法。恒温下,向体积为
的另一种方法。恒温下,向体积为 密闭容器中分别充入
密闭容器中分别充入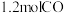 和
和 ,发生反应:
,发生反应: 后达到平衡状态,测得混合体系中含
后达到平衡状态,测得混合体系中含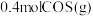 。
。
①平衡时, 的浓度为
的浓度为_____________  ;
; 内用
内用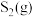 表示的化学反应速率
表示的化学反应速率_____________  。
。
②下列描述中能说明上述反应已达平衡状态的是_____________ (填字母)。
a.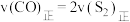
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器内气体压强保持不变
 ,沸点:
,沸点: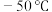 )又称氧硫化碳,其结构与
)又称氧硫化碳,其结构与 类似.回答下列问题:
类似.回答下列问题:(1)实验室中通常用粉状硫氰化钾、水和浓硫酸反应制备
 ,同时生成两种硫酸氢盐。写出该反应的化学方程式:
,同时生成两种硫酸氢盐。写出该反应的化学方程式:(2)以
 为原料制备其他含硫物质的流程如下(部分产物已略去):
为原料制备其他含硫物质的流程如下(部分产物已略去): 溶液
溶液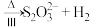
①反应Ⅰ中另一种产物是
②写出反应Ⅲ的离子方程式:
(3)
 和
和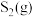 反应是制备
反应是制备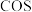 的另一种方法。恒温下,向体积为
的另一种方法。恒温下,向体积为 密闭容器中分别充入
密闭容器中分别充入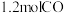 和
和 ,发生反应:
,发生反应: 后达到平衡状态,测得混合体系中含
后达到平衡状态,测得混合体系中含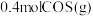 。
。①平衡时,
 的浓度为
的浓度为 ;
; 内用
内用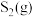 表示的化学反应速率
表示的化学反应速率 。
。②下列描述中能说明上述反应已达平衡状态的是
a.
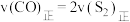
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器内气体压强保持不变
您最近一年使用:0次
名校
解题方法
6 . 以太阳能为热源分解 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是
 ,铁氧化合物循环分解水制
,铁氧化合物循环分解水制 的过程如图所示。下列说法错误的是
的过程如图所示。下列说法错误的是
| A.过程Ⅰ、Ⅱ发生的反应均属于氧化还原反应 |
| B.该制氢过程中,固体的颜色不会发生变化 |
C.过程Ⅰ中每消耗116g ,理论上转移2mol电子 ,理论上转移2mol电子 |
D.过程Ⅱ的化学方程式为 |
您最近一年使用:0次
2023-12-31更新
|
133次组卷
|
2卷引用:陕西省榆林市十校联考2023-2024学年高一上学期12月月考化学试题
7 .  可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
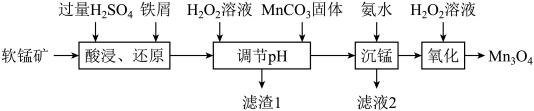
25℃时,相关金属离子 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有_______ (举1例)。
(2)“酸浸、还原”后溶液中含有的金属阳离子有 、
、_______ (填离子符号),铁屑、 与
与 反应的离子方程式为
反应的离子方程式为_______ 。
(3)“调节pH”时,加入 溶液的目的是
溶液的目的是_______ ,“调节pH”的范围为_______ 。滤渣1的主要成分是 、
、 和
和_______ 。
(4)“沉锰”时发生反应的离子方程式为_______ 。
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是_______ 。
 可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是
可用于电子工业生产软磁铁氧体,用作电子计算机中存储信息的磁芯、磁盘等。工业上以软锰矿(主要成分是 ,还含有少量的
,还含有少量的 、
、 、
、 )为原料生产
)为原料生产 的工艺流程如下:
的工艺流程如下:
25℃时,相关金属离子
 形成氢氧化物沉淀的pH范围如下:
形成氢氧化物沉淀的pH范围如下:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.5 | 6.3 | 3.4 | 8.1 |
| 沉淀完全的pH | 2.8 | 8.3 | 4.7 | 10.1 |
(1)“酸浸、还原”时,为提高酸浸速率,可采取的措施有
(2)“酸浸、还原”后溶液中含有的金属阳离子有
 、
、 与
与 反应的离子方程式为
反应的离子方程式为(3)“调节pH”时,加入
 溶液的目的是
溶液的目的是 、
、 和
和(4)“沉锰”时发生反应的离子方程式为
(5)“氧化”时一般控制温度在80℃~85℃,可采取的加热方法是
您最近一年使用:0次
解题方法
8 . 优化的 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
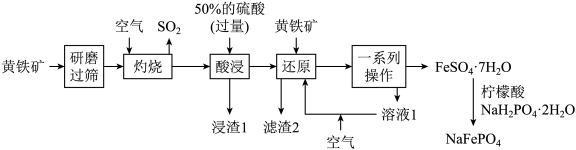
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度 时,认为沉淀完全,
时,认为沉淀完全, )
)
回答下列问题:
(1) 中
中 元素化合价为
元素化合价为___________ 价;“研磨”的目的是___________ 。
(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为___________ (填一种)。
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为___________ (答一条即可)。
(4)“浸渣1”的主要成分是___________ (填化学式),列举出一种该物质的用途:___________ 。
(5)“还原”中 与
与 反应的离子方程式为
反应的离子方程式为___________ ;通入空气的条件下,“溶液1”可在“还原”步骤中循环利用,则通入空气的目的是___________ 。
(6)“一系列操作”包括___________ 、___________ 、过滤、洗涤和低温干燥。
 复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是
复合材料作钠离子电池的正极材料时表现出优异的循环稳定性。以黄铁矿(主要成分是 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备 的流程如图所示。
的流程如图所示。
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当离子的物质的量浓度
 时,认为沉淀完全,
时,认为沉淀完全, )
)| 离子 |  |  |
 |  | 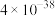 |
(1)
 中
中 元素化合价为
元素化合价为(2)“灼烧”时的大量尾气直接排放,会引起的主要环境问题为
(3)常温下,“酸浸”时,加入过量50%的硫酸的目的为
(4)“浸渣1”的主要成分是
(5)“还原”中
 与
与 反应的离子方程式为
反应的离子方程式为(6)“一系列操作”包括
您最近一年使用:0次
2023-05-07更新
|
349次组卷
|
2卷引用:陕西省榆林市2023届高三下学期第四次模拟检测理综化学试题
9 . 把Cl2通入浓氨水中,发生如下反应:3Cl2+8NH3=6NH4Cl+N2
(1)用单线桥表示反应的电子转移方向和数目:______________ 。
(2)反应中发生电子转移的NH3与Cl2的分子数之比为:_______ 。
(3)若反应中有3.4克氨发生氧化反应,则反应中生成氮气的质量为_______ 。
(4)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:Fe(OH)3+NaOH+NaClO—Na2FeO4+NaCl+H2O
①该反应中(用化学式表示,下同),还原产物为_______ ,_______ 元素被氧化。
②配平该反应的方程式:_____________________ 。
(1)用单线桥表示反应的电子转移方向和数目:
(2)反应中发生电子转移的NH3与Cl2的分子数之比为:
(3)若反应中有3.4克氨发生氧化反应,则反应中生成氮气的质量为
(4)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:Fe(OH)3+NaOH+NaClO—Na2FeO4+NaCl+H2O
①该反应中(用化学式表示,下同),还原产物为
②配平该反应的方程式:
您最近一年使用:0次
10 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作___________ 极(填“阴”或“阳”)。
(2)Se与 处于同一主族,比
处于同一主族,比 原子多1个电子层,Se的原子序数为
原子多1个电子层,Se的原子序数为___________ ,最高价氧化物的化学式为___________ 。
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i、将含硒阳极泥与浓硫酸混合焙烧,产生 的混合气体;
的混合气体;
ii、用水吸收i中混合气体,可得Se固体。
①请写出 与浓
与浓 反应的化学方程式
反应的化学方程式___________ 。
②焙烧过程产生的烟气中含有少量 ,可用
,可用 溶液吸收,二者反应生成一种盐,该盐的化学式为
溶液吸收,二者反应生成一种盐,该盐的化学式为___________ 。
③写出步骤ii中的化学方程式___________ 。
(1)粗铜精炼时,通常用精铜作
(2)Se与
 处于同一主族,比
处于同一主族,比 原子多1个电子层,Se的原子序数为
原子多1个电子层,Se的原子序数为(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
i、将含硒阳极泥与浓硫酸混合焙烧,产生
 的混合气体;
的混合气体;ii、用水吸收i中混合气体,可得Se固体。
①请写出
 与浓
与浓 反应的化学方程式
反应的化学方程式②焙烧过程产生的烟气中含有少量
 ,可用
,可用 溶液吸收,二者反应生成一种盐,该盐的化学式为
溶液吸收,二者反应生成一种盐,该盐的化学式为③写出步骤ii中的化学方程式
您最近一年使用:0次



