解题方法
1 .  (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
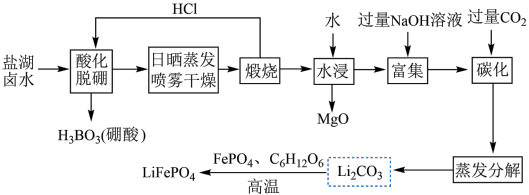
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、 等。
等。
(1) 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第___________ 周期___________ 族。
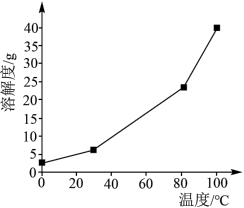
(2)硼酸在水中的溶解度随温度的变化关系如图所示。
已知: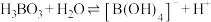
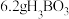 最多与
最多与___________  溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用___________ (填“加热”或“冷却”),采用该操作的目的是___________ 。
(3)“煅烧”过程中,常需要搅拌,搅拌的目的是___________ 。
(4)“蒸发分解”的化学方程式为___________ 。
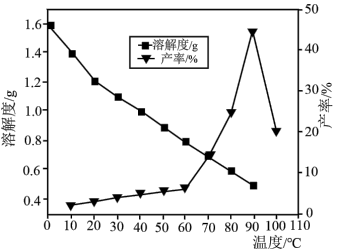
(5)已知不同温度下蒸发分解得到 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是___________ ,制得 后需要洗涤,具体操作为
后需要洗涤,具体操作为___________ 。
(6)用 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 (简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、
(简称LFP)主要用于各种锂离子电池,是最安全的锂离子电池正极材料,不含任何对人体有害的重金属元素。以盐湖卤水(主要含有NaCl、 、LiCl和
、LiCl和 等)为原料制备
等)为原料制备 的工艺流程如图。
的工艺流程如图。
注:日晒蒸发、喷雾干燥后固体含NaCl、LiCl、
 等。
等。(1)
 中Li在元素周期表中的位置为第
中Li在元素周期表中的位置为第(2)硼酸在水中的溶解度随温度的变化关系如图所示。

已知:
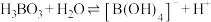
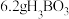 最多与
最多与 溶液完全反应。“酸化脱硼”中采用
溶液完全反应。“酸化脱硼”中采用(3)“煅烧”过程中,常需要搅拌,搅拌的目的是
(4)“蒸发分解”的化学方程式为
(5)已知不同温度下蒸发分解得到
 的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是
的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是 后需要洗涤,具体操作为
后需要洗涤,具体操作为
(6)用
 、
、 、
、 制备
制备 时,有
时,有 产生,则参与反应的
产生,则参与反应的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2 . 回答下列问题:
(1)中国古代著作中有“银针验毒”的记录,其原理为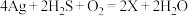 ,则X的化学式是
,则X的化学式是_______ ,其中 在该反应中
在该反应中_______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:
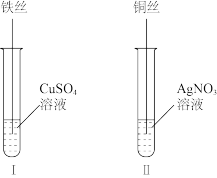
①Ⅱ中铜丝上观察到的现象是_______ 。
②结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
(3)已知 可发生反应:
可发生反应: 。
。
①该反应中被还原的元素是_______ (填化学式,下同),氧化产物是_______ 。
②某温度下,将 通入
通入 溶液中,反应后得到
溶液中,反应后得到 、
、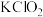 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的数目之比为1:2,该反应的化学反应方程式为
的数目之比为1:2,该反应的化学反应方程式为_______ 。
(1)中国古代著作中有“银针验毒”的记录,其原理为
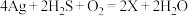 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:

①Ⅱ中铜丝上观察到的现象是
②结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(3)已知
 可发生反应:
可发生反应: 。
。①该反应中被还原的元素是
②某温度下,将
 通入
通入 溶液中,反应后得到
溶液中,反应后得到 、
、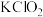 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的数目之比为1:2,该反应的化学反应方程式为
的数目之比为1:2,该反应的化学反应方程式为
您最近一年使用:0次
2023-10-15更新
|
0次组卷
|
3卷引用:陕西省汉中市南郑区铁佛中学2023-2024学年高一上学期12月月考化学试题
解题方法
3 . 高纯度硫酸锰是制作锂电池正极的主要原料之一,随着新能源车的兴起,对高纯度硫酸锰的需求量越来越大。一种以钨冶炼渣(主要成分为 、
、 ,还含有
,还含有 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯硫酸锰的工艺流程如图:
等杂质)为原料制备高纯硫酸锰的工艺流程如图:

已知:①当温度低于25℃时,硫酸锰的溶解度随温度的升高而增大;当温度高于25℃时,硫酸锰的溶解度随温度的升高而减小。
②金属离子在水溶液中形成沉淀的 范围如表所示(25℃):
范围如表所示(25℃):
回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 价;“浸出”时搅拌的目的是___________ 。
(2)在实验室进行分离出“废渣1”的操作时需要的玻璃仪器有___________ 。
(3)通常“氧化”时加入的 是过量的,分析可能原因:
是过量的,分析可能原因:___________ (写一条)
(4)“调 除杂”的目的是除去
除杂”的目的是除去 、
、 元素,则调节溶液的
元素,则调节溶液的 的最佳范围为
的最佳范围为___________ 。
(5)“氟化除杂”后,测得溶液中 为
为 ,则溶液中
,则溶液中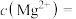
___________  。[已知:
。[已知: ;
; ]
]
(6)“酸溶”时发生反应的化学方程式为___________ ,“系列操作”的具体步骤为___________ 、洗涤、干燥。
 、
、 ,还含有
,还含有 、
、 、
、 、
、 、
、 等杂质)为原料制备高纯硫酸锰的工艺流程如图:
等杂质)为原料制备高纯硫酸锰的工艺流程如图:
已知:①当温度低于25℃时,硫酸锰的溶解度随温度的升高而增大;当温度高于25℃时,硫酸锰的溶解度随温度的升高而减小。
②金属离子在水溶液中形成沉淀的
 范围如表所示(25℃):
范围如表所示(25℃):| 物质 |  |  |  |  |
开始沉淀的 | 1.9 | 7.6 | 7.3 | 3.0 |
完全沉淀的 | 3.2 | 9.6 | 9.3 | 5.2 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)在实验室进行分离出“废渣1”的操作时需要的玻璃仪器有
(3)通常“氧化”时加入的
 是过量的,分析可能原因:
是过量的,分析可能原因:(4)“调
 除杂”的目的是除去
除杂”的目的是除去 、
、 元素,则调节溶液的
元素,则调节溶液的 的最佳范围为
的最佳范围为(5)“氟化除杂”后,测得溶液中
 为
为 ,则溶液中
,则溶液中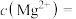
 。[已知:
。[已知: ;
; ]
](6)“酸溶”时发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
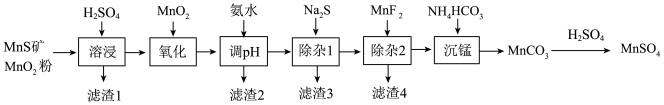
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)为了加快溶浸效果,可采取的措施有_______ (任写一条);写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式_______ 。
(3)滤渣2除了含有Al(OH)3还含有_______ 。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_______ 。
(5)写出“沉锰”的离子方程式_______ 。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=_______ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式
(3)滤渣2除了含有Al(OH)3还含有
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)写出“沉锰”的离子方程式
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2023-08-27更新
|
211次组卷
|
3卷引用:陕西省汉中中学2024届高三上学期8月质量检测化学试题
5 . 化学与人类生产、生活密切相关,按要求回答下列问题。
(1)工业上制造光导纤维的基本原料是_______ (填化学式)。
(2)钠的化合物中,可用作潜水艇中供氧剂的是_______ ,其与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
(4)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是_______ (填化学式)。
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目_______ 。若反应中共转移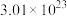 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为_______ L(标准状况下)。
(1)工业上制造光导纤维的基本原料是
(2)钠的化合物中,可用作潜水艇中供氧剂的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
A. | B. | C. | D. |
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目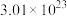 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为
您最近一年使用:0次
2023-07-31更新
|
361次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一上学期期末考试化学试题
陕西省汉中市2020-2021学年高一上学期期末考试化学试题(已下线)结构与性质(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
6 . 高锰酸钾是一种典型的强氧化剂。
Ⅰ.用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:
①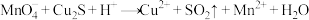 (未配平)
(未配平)
②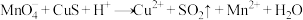 (未配平)
(未配平)
(1)反应①中被氧化的元素是__________ ,氧化剂与还原剂的物质的量之比为__________ 。
(2)当反应①中转移0.8mol电子,生成 的体积为
的体积为__________ L(标准状况下)。
(3)配平并用单线桥法标出反应②中电子转移的方向和数目______________ 。
Ⅱ.在稀硫酸中, 和
和 能发生氧化还原反应:
能发生氧化还原反应:
氧化反应:
还原反应:
(4)写出该氧化还原反应的离子方程式______________________________ 。
(5)反应中若有 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为__________ 。
(6)由上述反应得出物质氧化性强弱的结论是
__________ (填“>”或“<”) 。
。
(7)实验中发现,当加入的少量 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是__________ 。
Ⅰ.用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:①
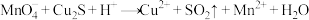 (未配平)
(未配平)②
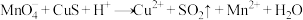 (未配平)
(未配平)(1)反应①中被氧化的元素是
(2)当反应①中转移0.8mol电子,生成
 的体积为
的体积为(3)配平并用单线桥法标出反应②中电子转移的方向和数目
Ⅱ.在稀硫酸中,
 和
和 能发生氧化还原反应:
能发生氧化还原反应:氧化反应:

还原反应:

(4)写出该氧化还原反应的离子方程式
(5)反应中若有
 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为(6)由上述反应得出物质氧化性强弱的结论是

 。
。(7)实验中发现,当加入的少量
 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是
您最近一年使用:0次
解题方法
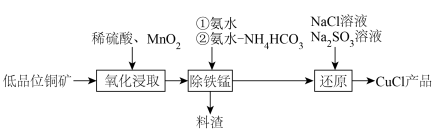
7 . 氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
已知:①室温下,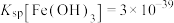 ;
;
②CuCl易被 氧化且在溶液中易与
氧化且在溶液中易与 形成可溶的
形成可溶的 。
。
回答下列问题:
(1)“氧化浸取”时,铜元素全部转化为 ,铁元素全部转化为
,铁元素全部转化为 。
。
① 、
、 和稀硫酸反应生成
和稀硫酸反应生成 ,
, 和S的离子方程式为
和S的离子方程式为___________ 。
②为提高铜元素的浸出率,工艺上可采取的措施有___________ (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量 C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、再用氨水— 混合溶液沉锰。
混合溶液沉锰。
①室温下,用氨水调节溶液的pH为3时, 为
为___________  。
。
②向除铁后的溶液中滴加氨水— 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为___________ 。
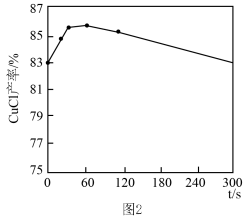
(3)①“还原”时,反应生成CuCl的离子方程式为___________ ;如图1所示,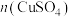 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是___________ 。

②如图2所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是___________ 。
 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
已知:①室温下,
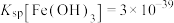 ;
;②CuCl易被
 氧化且在溶液中易与
氧化且在溶液中易与 形成可溶的
形成可溶的 。
。回答下列问题:
(1)“氧化浸取”时,铜元素全部转化为
 ,铁元素全部转化为
,铁元素全部转化为 。
。①
 、
、 和稀硫酸反应生成
和稀硫酸反应生成 ,
, 和S的离子方程式为
和S的离子方程式为②为提高铜元素的浸出率,工艺上可采取的措施有
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量 C.适当提高硫酸浓度 D.适当缩短反应时间
(2)“除铁锰”。依次用氨水沉铁、再用氨水—
 混合溶液沉锰。
混合溶液沉锰。①室温下,用氨水调节溶液的pH为3时,
 为
为 。
。②向除铁后的溶液中滴加氨水—
 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为(3)①“还原”时,反应生成CuCl的离子方程式为
 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是
②如图2所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是

您最近一年使用:0次
2023-07-16更新
|
257次组卷
|
2卷引用:2024届陕西省汉中市汉台区高三下学期教学质量检测(一模)理综试题-高中化学
解题方法
8 . 钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
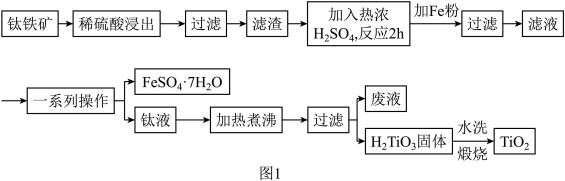
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是___________ 。
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是___________ 和___________ ,原因为___________ 。

(3)若用浓硫酸浸出后Ti元素的存在形式为 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为___________ 。
(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是___________ ,过滤时用到的玻璃仪器有玻璃棒、___________ 。
(5)将钛液加热煮沸的目的是___________ 。
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为___________ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)若用浓硫酸浸出后Ti元素的存在形式为
 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是
(5)将钛液加热煮沸的目的是
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为
您最近一年使用:0次
9 . “绿水青山就是金山银山”是重要的发展理念,研究 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。
(1)钙基固硫技术可减少 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应①:
反应②:
反应③:
___________ (填含 、
、 的代数式)。
的代数式)。
(2) 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。
①有人利用尿素水溶液热解产生的 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;

a.尿素 中氮元素的化合价为
中氮元素的化合价为___________ 。
b.若氧化处理后的尾气中混有 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:___________ 。
②某种脱硝反应机理如图2所示, 参与的反应
参与的反应 的方程式为
的方程式为___________ 。

③实验室模拟汽车尾气转化器中的反应 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入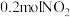 和
和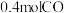 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为___________ 。
④一定条件下,反应 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第___________ 步是决速步骤。在恒温恒容密闭容器中进行上述反应,原料组成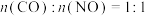 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为___________ 。

 、
、 、
、 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。(1)钙基固硫技术可减少
 排放,但煤炭燃烧过程中产生的
排放,但煤炭燃烧过程中产生的 又会与
又会与 发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:反应①:

反应②:

反应③:

 、
、 的代数式)。
的代数式)。(2)
 的排放主要来自汽车尾气。
的排放主要来自汽车尾气。①有人利用尿素水溶液热解产生的
 去除尾气中的
去除尾气中的 ,流程如图1;
,流程如图1;
a.尿素
 中氮元素的化合价为
中氮元素的化合价为b.若氧化处理后的尾气中混有
 ,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低
,此时催化剂表面会覆盖部分硫酸盐,导致催化剂中毒,降低 的去除率。试分析硫酸盐的产生过程:
的去除率。试分析硫酸盐的产生过程:②某种脱硝反应机理如图2所示,
 参与的反应
参与的反应 的方程式为
的方程式为
③实验室模拟汽车尾气转化器中的反应
 。在2L的恒容密闭容器中,投入
。在2L的恒容密闭容器中,投入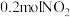 和
和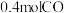 ,一段时间后反应达到平衡状态,测得
,一段时间后反应达到平衡状态,测得 的转化率为
的转化率为 。该温度下,反应的平衡常数为
。该温度下,反应的平衡常数为④一定条件下,反应
 的反应历程如图3所示,该历程分三步进行,其中第
的反应历程如图3所示,该历程分三步进行,其中第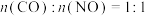 ,体系达到平衡时
,体系达到平衡时 的体积分数为
的体积分数为 ,则
,则 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
2023-07-06更新
|
97次组卷
|
2卷引用:陕西省汉中市2022-2023学年高二下学期期末联考化学试题
名校
解题方法
10 . 某研究性学习小组对实验室中 制取、收集、吸收以及
制取、收集、吸收以及 的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。

Ⅰ. 的收集和吸收
的收集和吸收
(1)用图甲装置收集 ,气体应从
,气体应从___________ (填“m”或“n”)口进入。
(2)已知 难溶于
难溶于 。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收 的是
的是___________ 。
Ⅱ. 的还原性探究
的还原性探究
利用如图装置,进行 还原
还原 的反应。
的反应。

已知: 与
与 反应的生成物为
反应的生成物为 、
、 和无毒气体X,且X不被浓硫酸和碱石灰吸收。
和无毒气体X,且X不被浓硫酸和碱石灰吸收。
(3)采用上图装置A作为 的发生装置,写出该反应的化学方程式
的发生装置,写出该反应的化学方程式___________ 。
(4)按气流从左到右的方向装置的正确连接顺序为:___________ 。
A→___________→___________→___________→___________→C(填字母,每个装置只用一次)。
(5)实验结束时,应首先___________ (填序号)。
①熄灭A装置的酒精灯
②熄灭B装置的酒精灯
(6)若称取1.6g 完全反应后,测得生成气体X的体积为224
完全反应后,测得生成气体X的体积为224 (标准状况下),通过计算推测X的化学式为
(标准状况下),通过计算推测X的化学式为___________ 。
(7)装置B中 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
 制取、收集、吸收以及
制取、收集、吸收以及 的还原性探究进行了如下实验设计。
的还原性探究进行了如下实验设计。
Ⅰ.
 的收集和吸收
的收集和吸收(1)用图甲装置收集
 ,气体应从
,气体应从(2)已知
 难溶于
难溶于 。图乙、丙、丁、戊四种装置中,不能用来吸收
。图乙、丙、丁、戊四种装置中,不能用来吸收 的是
的是Ⅱ.
 的还原性探究
的还原性探究利用如图装置,进行
 还原
还原 的反应。
的反应。
已知:
 与
与 反应的生成物为
反应的生成物为 、
、 和无毒气体X,且X不被浓硫酸和碱石灰吸收。
和无毒气体X,且X不被浓硫酸和碱石灰吸收。(3)采用上图装置A作为
 的发生装置,写出该反应的化学方程式
的发生装置,写出该反应的化学方程式(4)按气流从左到右的方向装置的正确连接顺序为:
A→___________→___________→___________→___________→C(填字母,每个装置只用一次)。
(5)实验结束时,应首先
①熄灭A装置的酒精灯
②熄灭B装置的酒精灯
(6)若称取1.6g
 完全反应后,测得生成气体X的体积为224
完全反应后,测得生成气体X的体积为224 (标准状况下),通过计算推测X的化学式为
(标准状况下),通过计算推测X的化学式为(7)装置B中
 与
与 反应的化学方程式为
反应的化学方程式为
您最近一年使用:0次
2023-03-12更新
|
511次组卷
|
3卷引用:陕西省汉中市2020-2021学年高二下学期期中联考化学试题
陕西省汉中市2020-2021学年高二下学期期中联考化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高一下学期3月月考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(实验综合题)



