解题方法
1 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。如图为氯元素的“价—类”二维图。
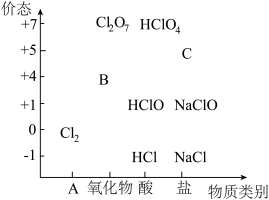
请回答下列问题:
(1)二维图中类别 A 是_______ ; B 可以代替(  2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是_______ (填化学式,下同);C的焰色试验呈紫色,则C是_______ 。
(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与_______ (填序号)发生反应;从化合价角度看,盐酸中 Cl⁻具有_______ 性,可能与_______ (填序号)发生反应。
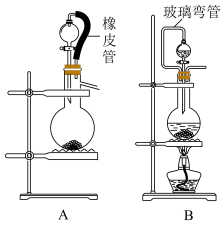
(3)实验室常用 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的_______ (填“A”或“B”)作为发生装置,反应的离子方程式为_______ 。
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为: 2
2 2
2 2
2 2
2 。
。
①该反应说明氧化性:NaClO_______ O2(填“>”、“<”或“=”)。
②用单线桥法表示该反应电子转移的方向和数目:_______ 。
(5)一定温度下, 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为_______ 。

请回答下列问题:
(1)二维图中类别 A 是
 2成为新时代自来水消毒剂,则 B是
2成为新时代自来水消毒剂,则 B是(2)某同学利用①FeO、②KMnO4、③NaOH 探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
(3)实验室常用
 2固体和浓盐酸制取
2固体和浓盐酸制取 2,可选用下图中的
2,可选用下图中的
(4)若将84 消毒液与双氧水混用给游泳池消毒,反应产生的 O2会促进藻类快速生长,使池水变绿,其反应原理为:
 2
2 2
2 2
2 2
2 。
。①该反应说明氧化性:NaClO
②用单线桥法表示该反应电子转移的方向和数目:
(5)一定温度下,
 2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与
2与 NaOH溶 液反应生成NaCl、NaClO和 NaClO3的混合物,若 NaClO与  3的系数之比为3∶1,则反应的离子方程式为
3的系数之比为3∶1,则反应的离子方程式为
您最近一年使用:0次
2 . 回答下列问题:
(1)中国古代著作中有“银针验毒”的记录,其原理为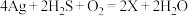 ,则X的化学式是
,则X的化学式是_______ ,其中 在该反应中
在该反应中_______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:
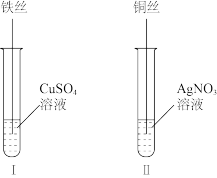
①Ⅱ中铜丝上观察到的现象是_______ 。
②结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
(3)已知 可发生反应:
可发生反应: 。
。
①该反应中被还原的元素是_______ (填化学式,下同),氧化产物是_______ 。
②某温度下,将 通入
通入 溶液中,反应后得到
溶液中,反应后得到 、
、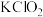 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的数目之比为1:2,该反应的化学反应方程式为
的数目之比为1:2,该反应的化学反应方程式为_______ 。
(1)中国古代著作中有“银针验毒”的记录,其原理为
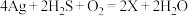 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:

①Ⅱ中铜丝上观察到的现象是
②结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(3)已知
 可发生反应:
可发生反应: 。
。①该反应中被还原的元素是
②某温度下,将
 通入
通入 溶液中,反应后得到
溶液中,反应后得到 、
、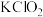 、
、 的混合溶液,经测定
的混合溶液,经测定 与
与 的数目之比为1:2,该反应的化学反应方程式为
的数目之比为1:2,该反应的化学反应方程式为
您最近一年使用:0次
2023-10-15更新
|
0次组卷
|
3卷引用:陕西省汉中市南郑区铁佛中学2023-2024学年高一上学期12月月考化学试题
3 . 化学与人类生产、生活密切相关,按要求回答下列问题。
(1)工业上制造光导纤维的基本原料是_______ (填化学式)。
(2)钠的化合物中,可用作潜水艇中供氧剂的是_______ ,其与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
(4)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是_______ (填化学式)。
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目_______ 。若反应中共转移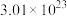 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为_______ L(标准状况下)。
(1)工业上制造光导纤维的基本原料是
(2)钠的化合物中,可用作潜水艇中供氧剂的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
A. | B. | C. | D. |
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目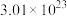 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为
您最近一年使用:0次
2023-07-31更新
|
360次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一上学期期末考试化学试题
陕西省汉中市2020-2021学年高一上学期期末考试化学试题(已下线)结构与性质(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
4 . 高锰酸钾是一种典型的强氧化剂。
Ⅰ.用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:
①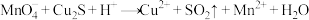 (未配平)
(未配平)
②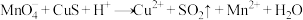 (未配平)
(未配平)
(1)反应①中被氧化的元素是__________ ,氧化剂与还原剂的物质的量之比为__________ 。
(2)当反应①中转移0.8mol电子,生成 的体积为
的体积为__________ L(标准状况下)。
(3)配平并用单线桥法标出反应②中电子转移的方向和数目______________ 。
Ⅱ.在稀硫酸中, 和
和 能发生氧化还原反应:
能发生氧化还原反应:
氧化反应:
还原反应:
(4)写出该氧化还原反应的离子方程式______________________________ 。
(5)反应中若有 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为__________ 。
(6)由上述反应得出物质氧化性强弱的结论是
__________ (填“>”或“<”) 。
。
(7)实验中发现,当加入的少量 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是__________ 。
Ⅰ.用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:①
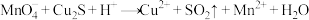 (未配平)
(未配平)②
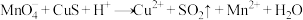 (未配平)
(未配平)(1)反应①中被氧化的元素是
(2)当反应①中转移0.8mol电子,生成
 的体积为
的体积为(3)配平并用单线桥法标出反应②中电子转移的方向和数目
Ⅱ.在稀硫酸中,
 和
和 能发生氧化还原反应:
能发生氧化还原反应:氧化反应:

还原反应:

(4)写出该氧化还原反应的离子方程式
(5)反应中若有
 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为(6)由上述反应得出物质氧化性强弱的结论是

 。
。(7)实验中发现,当加入的少量
 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是
您最近一年使用:0次
解题方法
5 . 钛白粉(纳米级TiO2)广泛用作功能陶瓷、催化剂、化妆品和光敏材料等白色无机颜料,是白色颜料中着色力最强的一种,具有优良的遮盖力和着色牢度,适用于不透明的白色制品。以钛铁矿(主要成分为FeTiO3、MgO)为原料制备高纯度钛白粉,同时得到绿矾的工艺流程如图1。
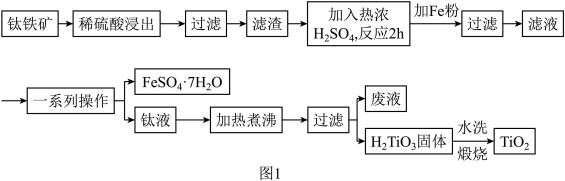
已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是___________ 。
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是___________ 和___________ ,原因为___________ 。

(3)若用浓硫酸浸出后Ti元素的存在形式为 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为___________ 。
(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是___________ ,过滤时用到的玻璃仪器有玻璃棒、___________ 。
(5)将钛液加热煮沸的目的是___________ 。
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为___________ kg。

已知:常温下,稀硫酸几乎与FeTiO3不反应。
(1)稀硫酸浸出的目的是
(2)图2、图3分别为不同固液比、温度下滤渣与热浓硫酸反应时的Ti浸出率,据图分析,最适合的固液比和温度分别是

(3)若用浓硫酸浸出后Ti元素的存在形式为
 ,则浓硫酸与FeTiO3反应的化学方程式为
,则浓硫酸与FeTiO3反应的化学方程式为(4)“一系列操作”得到的绿矾先用稀钛液洗涤,再用冰水洗涤的目的是
(5)将钛液加热煮沸的目的是
(6)若取10kg钛铁矿(FeTiO3的质量分数为95%,)经过上述流程(钛元素在整个流程中损失率为5%),则可制得钛白粉固体的质量为
您最近一年使用:0次
解题方法
6 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备含氯化合物的主要原料,实验室制取 的化学反应方程式为
的化学反应方程式为_______ 。
(2)如图所示是有关 的实验:
的实验:

①图Ⅰ是验证氯气性质的实验,为除去HCl,A瓶中应装入的试剂是_______ ;能说明氯气与水发生反应的实验现象是_______ ,烧杯中NaOH溶液的作用是_______ (用离子方程式表示)。
②图Ⅱ是纯净的氢气在氯气中燃烧的实验,可观察到的现象是_______ 。
(3) 可用于水的消毒,同时
可用于水的消毒,同时 还可将水中的
还可将水中的 转化为
转化为 ,说明
,说明 具有
具有_______ (填“氧化”或“还原”)性。
(4)漂白粉的有效成分是_______ (填化学式),漂白粉溶于水受空气中的 作用,具有漂白、杀菌作用,发生反应的化学方程式为
作用,具有漂白、杀菌作用,发生反应的化学方程式为_______ 。
(5)人们常用“84”消毒液进行消毒。“84”消毒液不能与洁厕灵(含盐酸)混用的原因是_______ (用离子方程式表示)。
(1)氯气是制备含氯化合物的主要原料,实验室制取
 的化学反应方程式为
的化学反应方程式为(2)如图所示是有关
 的实验:
的实验:
①图Ⅰ是验证氯气性质的实验,为除去HCl,A瓶中应装入的试剂是
②图Ⅱ是纯净的氢气在氯气中燃烧的实验,可观察到的现象是
(3)
 可用于水的消毒,同时
可用于水的消毒,同时 还可将水中的
还可将水中的 转化为
转化为 ,说明
,说明 具有
具有(4)漂白粉的有效成分是
 作用,具有漂白、杀菌作用,发生反应的化学方程式为
作用,具有漂白、杀菌作用,发生反应的化学方程式为(5)人们常用“84”消毒液进行消毒。“84”消毒液不能与洁厕灵(含盐酸)混用的原因是
您最近一年使用:0次
2023-02-04更新
|
309次组卷
|
2卷引用:陕西省汉中市多校2022-2023学年高一上学期期末校际联考化学试题
7 .  具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。
(1)实验室检验 的方法为
的方法为_______ 。 溶液对钢铁设备的腐蚀,除
溶液对钢铁设备的腐蚀,除 的腐蚀作用外,另一离子的腐蚀主要原因是
的腐蚀作用外,另一离子的腐蚀主要原因是_______ (用离子方程式表示)
(2)实验室可用NaClO氧化酸性 废液得到
废液得到 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。若要制取1000mL2mol/L ,则需要NaClO的质量为
,则需要NaClO的质量为_______ g。
(3)通过控制条件, 溶液的水解产物聚合,生成聚合氯化铁,离子方程式为
溶液的水解产物聚合,生成聚合氯化铁,离子方程式为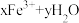
 。欲使平衡正向移动可采用的方法是_______(填字母)。
。欲使平衡正向移动可采用的方法是_______(填字母)。
(4)工业上可用废铁屑来制备 ,流程如下:
,流程如下:
废铁屑
 晶体
晶体 无水
无水
①在HCl气流中加热的原因是_______ 。
②若某废铁屑中铁的质量分数为84%,用1000g废铁屑反应,最后制取的 质量为1625g,则该制取过程中的产率为
质量为1625g,则该制取过程中的产率为_______ (精确到0.1%)
 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。
高效,且腐蚀性小。(1)实验室检验
 的方法为
的方法为 溶液对钢铁设备的腐蚀,除
溶液对钢铁设备的腐蚀,除 的腐蚀作用外,另一离子的腐蚀主要原因是
的腐蚀作用外,另一离子的腐蚀主要原因是(2)实验室可用NaClO氧化酸性
 废液得到
废液得到 ,发生反应的离子方程式为
,发生反应的离子方程式为 ,则需要NaClO的质量为
,则需要NaClO的质量为(3)通过控制条件,
 溶液的水解产物聚合,生成聚合氯化铁,离子方程式为
溶液的水解产物聚合,生成聚合氯化铁,离子方程式为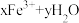
 。欲使平衡正向移动可采用的方法是_______(填字母)。
。欲使平衡正向移动可采用的方法是_______(填字母)。| A.降温 | B.加水稀释 | C.加入 | D.加入 |
 ,流程如下:
,流程如下:废铁屑

 晶体
晶体 无水
无水
①在HCl气流中加热的原因是
②若某废铁屑中铁的质量分数为84%,用1000g废铁屑反应,最后制取的
 质量为1625g,则该制取过程中的产率为
质量为1625g,则该制取过程中的产率为
您最近一年使用:0次
8 . ClO2是一种消毒杀菌效率高、污染少的绿色消毒剂。可以通过下列两种途径得到:
方法一:
方法二:
(1)用双线桥法表示方法一反应中电子转移的方向和数目。____________________
(2)方法一中浓盐酸在反应中显示出来的性质是__________(填字母)。
(3)配平方法二中的化学方程式。______________________________________
(4)方法二中的氧化剂为__________ (填化学式),在反应中发生______________ (填“氧化”或“还原”)反应。还原产物为_________ (填化学式)。
(5)上述反应为氧化还原反应,氧化还原反应原理在生活中广泛应用。下列物质的用途中,利用了氧化还原反应原理的是______________(填字母)。
方法一:

方法二:

(1)用双线桥法表示方法一反应中电子转移的方向和数目。
(2)方法一中浓盐酸在反应中显示出来的性质是__________(填字母)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)方法二中的氧化剂为
(5)上述反应为氧化还原反应,氧化还原反应原理在生活中广泛应用。下列物质的用途中,利用了氧化还原反应原理的是______________(填字母)。
| A.用盐酸除铁锈 | B.用赤铁矿炼铁 |
| C.生石灰作食品干燥剂 | D.用熟石灰改良酸性土壤 |
您最近一年使用:0次
9 . 《一种协同脱除VOCs和 的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除
的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除 是当前科学家研究的重要课题。
是当前科学家研究的重要课题。
(1) 对环境的一种危害是
对环境的一种危害是___________ 。
(2)碱性 氧化法可将
氧化法可将 进行脱除。
进行脱除。
① (NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整___________ 。
_____NO+_____ _____
_____
 ______
______ ____
____ ____
____
②下列叙述不正确的是___________ 填字时)。
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:
C.在不同酸碱性条件下, 发生氧化还原反应的产物可能不同
发生氧化还原反应的产物可能不同
③在实验室用 (NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为
(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为 ,理论上需要
,理论上需要 的质量为
的质量为___________ g( 靡尔质量为158
靡尔质量为158 )。
)。
(3)用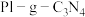 光催化氧化法脱除NO的过程如图所示。
光催化氧化法脱除NO的过程如图所示。

①该脱除过程中,太阳能转化为___________ 能。
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。 端的反应为
端的反应为
 ,P1端的反应为
,P1端的反应为___________ 。
 的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除
的催化剂及其制备方法》是华电光大(宜昌)环保技术有限公司于2021年2月25日申请的专利,脱除 是当前科学家研究的重要课题。
是当前科学家研究的重要课题。(1)
 对环境的一种危害是
对环境的一种危害是(2)碱性
 氧化法可将
氧化法可将 进行脱除。
进行脱除。①
 (NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整
(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整_____NO+_____
 _____
_____
 ______
______ ____
____ ____
____
②下列叙述不正确的是
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:

C.在不同酸碱性条件下,
 发生氧化还原反应的产物可能不同
发生氧化还原反应的产物可能不同③在实验室用
 (NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为
(NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为 ,理论上需要
,理论上需要 的质量为
的质量为 靡尔质量为158
靡尔质量为158 )。
)。(3)用
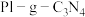 光催化氧化法脱除NO的过程如图所示。
光催化氧化法脱除NO的过程如图所示。
①该脱除过程中,太阳能转化为
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。
 端的反应为
端的反应为
 ,P1端的反应为
,P1端的反应为
您最近一年使用:0次
解题方法
10 . 铝及其化合物在生产生活中有着广泛的应用。
(1)Al﹣Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学反应方程式为_______ 。
(2)某同学实验时发现Al﹣Mg合金与NaOH溶液反应时的速率比纯铝与NaOH溶液反应时的速率快,原因是_______ 。
(3)饮用水中的 对人类健康会产生危害。为了降低饮用水中
对人类健康会产生危害。为了降低饮用水中 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为_______ 。
(4)碱式碳酸铝钠[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸铝钠。
①碱式碳酸铝钠[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为_______ 。
②碱式碳酸铝钠作为阻燃剂的可能原因是产生阻燃性气体CO2、H2O本身及产物无毒且不可燃;_______ 。
③若pH过高,则对产品的影响是_______ 。
(1)Al﹣Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学反应方程式为
(2)某同学实验时发现Al﹣Mg合金与NaOH溶液反应时的速率比纯铝与NaOH溶液反应时的速率快,原因是
(3)饮用水中的
 对人类健康会产生危害。为了降低饮用水中
对人类健康会产生危害。为了降低饮用水中 的浓度,有研究人员建议在碱性条件下用铝粉将
的浓度,有研究人员建议在碱性条件下用铝粉将 还原为N2,该反应的离子方程式为
还原为N2,该反应的离子方程式为(4)碱式碳酸铝钠[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸铝钠。
①碱式碳酸铝钠[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为
②碱式碳酸铝钠作为阻燃剂的可能原因是产生阻燃性气体CO2、H2O本身及产物无毒且不可燃;
③若pH过高,则对产品的影响是
您最近一年使用:0次



