名校
1 . 关于如图所示的转化过程的分析错误的是
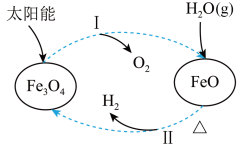
| A.Fe3O4中铁元素的化合价为+2、+3 |
| B.过程Ⅰ中每消耗58g Fe3O4转移1mol电子 |
C.过程Ⅱ中化学方程式为3FeO+H2O(g) Fe3O4+H2 Fe3O4+H2 |
| D.该过程总反应为2H2O(g)=O2+2H2 |
您最近一年使用:0次
2020-10-10更新
|
601次组卷
|
16卷引用:2019年陕西省汉中市高考第一次模拟化学试题
2019年陕西省汉中市高考第一次模拟化学试题山东济宁市兖州区2020届高三网络模拟考试化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(一)菏泽一中2020届高三3月份化学质量检测肥城一中2020届高三3月份在线检测化学试题上海市建平中学2021届高三上学期9月月考化学试题山东省济钢高级中学2021届高三10月质量检测化学试题高一必修第一册(苏教2019)专题4 专题综合检测卷福建省长泰县第一中学2021届高三上学期11月考试化学试题甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题(已下线)第12周 晚练题-备战2022年高考化学周测与晚练(新高考专用)河北师范大学田家炳中学2020-2021学年高一上学期第3次月考化学试题江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题江苏省无锡市辅仁高级中学2023-2024学年高一上学期期末复习化学模块综合试卷(一)11.2024年苏州木渎高级中学高一3月月考江苏省苏州第十中学校2023-2024学年高一下学期3月月考化学试题
名校
2 . 化学社的同学在实验时不小心沾了一些KMnO4在皮肤上,产生的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++____(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++____(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++____(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++____(未配平)。关于此反应的叙述正确的是| A.从反应中看出草酸性质很不稳定 | B.1mol 在反应中失去5mol电子 在反应中失去5mol电子 |
| C.该反应右横线上的产物是H2O | D.配平该反应后,H+的计量数是3 |
您最近一年使用:0次
2020-09-03更新
|
155次组卷
|
4卷引用:陕西省汉中市汉中中学2020-2021学年高一上学期期中考试化学试题
解题方法
3 . ZnSO4∙7H2O可用于测定钢铁及炉渣的含硫量。某工厂下脚料中含锌、镉(Cd)、铜、铁等金属,以该下脚料为原料制备ZnSO4∙7H2O并回收Cu、Cd的工艺流程如图所示:

已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
请回答下列问题:
(1)滤渣1中含有_______ (填化学式)。
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式_______ 。
(3)pH的调控范围是_______ ,试剂Y可选用_______ (填字母)
A. NaOH B. ZnO C. ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在_______ (填“阴”或“阳”)极析出,阳极的电极反应式为_______ 。
(5)操作I包括的操作是_______ 及过滤等,过滤后得到的滤液可以加入_______ (填“酸浸”或“氧化”)步骤循环利用。

已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.9 | 7.4 | 6.2 |
| 完全沉淀的pH | 3.2 | 9.5 | 8.2 |
请回答下列问题:
(1)滤渣1中含有
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式
(3)pH的调控范围是
A. NaOH B. ZnO C. ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在
(5)操作I包括的操作是
您最近一年使用:0次
名校
4 . 稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4;MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是( )
| A.MnO2吸收SO2的反应:MnO2+SO2═MnSO4 |
| B.MnO2作为碱性电池正极材料时的放电反应:MnO2+e−+H+═MnOOH |
| C.MnSO4与KMnO4反应制备MnO2:2MnO4−+3Mn2++2H2O═5MnO2+4H+ |
| D.尾气中的SO2还可用足量的氨水吸收:SO2+2NH3⋅H2O═2NH4++SO32−+H2O |
您最近一年使用:0次
2019-11-26更新
|
202次组卷
|
3卷引用:陕西省汉中市龙岗中学2020届高三第七次质量检测化学试题
5 . PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为___ 。
(2)对工艺流程图中的滤液处理办法最好的是:___
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为___ 。
(4)赶硝,是将残余的NO3−浓度降低到不大于0.04%。实验数据记录如表:
表一:不同HCl用量和MxOy用量(每10gPd)与NO3−残留量
处理1吨Pd,需要用到HCl和MxOy的总体积至少为___ m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:___ 。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。 写出反应原理中第一步的化学方程式:___

(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为
(2)对工艺流程图中的滤液处理办法最好的是:
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为
(4)赶硝,是将残余的NO3−浓度降低到不大于0.04%。实验数据记录如表:
表一:不同HCl用量和MxOy用量(每10gPd)与NO3−残留量
| HCl用量(mL) | MxOy用量(mL) | NO3−含量(%) |
| 5 | 0、10、20、30、40 | 0.15、0.10、0.05、0.04、0.03 |
| 10 | 0、5、10、15、20 | 0.10、0.08、0.05、0.03、0.02 |
| 15 | 0、5、10、15、20 | 0.08、0.06、0.05、0.03、0.02 |
处理1吨Pd,需要用到HCl和MxOy的总体积至少为
(5)煅烧过程发生分解反应,化学方程式为:
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。 写出反应原理中第一步的化学方程式:
您最近一年使用:0次
名校
6 . (1)K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O氧化剂是______ ,氧化产物与还原产物的物质的量之比为_______ 。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):①___ KMnO4+____ K2S+______ ===___ K2MnO4+___ K2SO4+___ S↓+______ 。
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为___ 。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为____ L。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2, 完成下列化学方程式(横线上填系数,括号内填物质):①
② 若生成6.4g单质硫,反应过程中转移电子的物质的量为
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
您最近一年使用:0次
2019-09-08更新
|
644次组卷
|
3卷引用:陕西省汉中市龙岗学校2019-2020学年高一上学期期中考试化学试题
名校
7 . 在酸性条件下,黄铁矿( FeS2)催化氧化的反应方程式为2FeS2+7O2+2H2O=2Fe2++4SO42-+4H+,实现该反应的物质间转化如图所示。下列分析错误的是


| A.反应I的离子方程式为4Fe(NO)2++O2+4H+= 4Fe3++4NO+2H2O |
| B.反应Ⅱ的氧化剂是Fe3+ |
| C.反应Ⅲ是氧化还原反应 |
| D.黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2019-09-04更新
|
769次组卷
|
16卷引用:陕西省汉中中学2021-2022学年高二下学期6月月考化学试题
陕西省汉中中学2021-2022学年高二下学期6月月考化学试题四川省成都市2020届高三高中毕业班摸底测试化学试题河北省衡水市衡水中学2019-2020学年高三上学期期中考试化学试题(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编四川省成都南开为明学校2019-2020学年高二上学期期中考试化学试题宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题广东省韶关市田家炳中学2020-2021学年高一上学期期中考试化学试题四川省绵阳市南山中学双语学校2020-2021学年高二下学期6月月考化学试题广东省普宁二中实验学校2021-2022学年高三上学期第一次月考化学试题(已下线)第4周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省景德镇市2022届高三第一次模拟化学试题黑龙江省哈尔滨市德强高中2021-2022学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期11月测试化学试题黑龙江省大庆铁人中学2021-2022学年高一下学期第一次月考化学试题辽宁省大连市金普新区省示范性高中联合体2021-2022学年高三上学期第二阶段考试化学试题(已下线)题型7 氧化还原反应原理在实际生产中的应用
8 . 实验室以MnO2、KClO3、CaCO3及盐酸等为原料制取KMnO4的步骤如下:
Ⅰ.MnO2的氧化
Ⅱ.CO2的制取
Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是____________________________ ;熔融时除了需要酒精灯、三脚架、坩埚钳、细铁棒及铁坩埚外,还需要的硅酸盐质仪器有___________________
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。

①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为______ 。

②为了充分利用CO2,实验开始时需关闭____________ (填“K1”“K2”“K3”“K4”或“K5”,下同),其余均打开;待“气球1”中收集到足够多的CO2时,关闭______ ,其余均打开。
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为______________________ 。
Ⅰ.MnO2的氧化

Ⅱ.CO2的制取

Ⅲ.K2MnO4的歧化及过滤和结晶等
回答下列问题:
(1)实验前称取2.5g KClO3、5.2g KOH、3.0g MnO2并充分混合。氯酸钾需过量,其原因是
(2)为了体现“绿色化学”理念,某同学设计了如图所示的“K2MnO4歧化”实验装置。在大试管中装入块状CaCO3,并关闭K2,向长颈漏斗中加入一定量6mol·L-1的盐酸;向三口烧瓶中加入K2MnO4溶液。

①实验时,不用装置(a)(启普发生器)制取CO2而用装置(b)制取,这是因为

②为了充分利用CO2,实验开始时需关闭
③三口烧瓶中物质发生反应生成KMnO4的同时还会生成MnO2和K2CO3,该反应的离子方程式为
您最近一年使用:0次
名校
9 . 元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为___________ 。
(2)利用铬铁矿(FeO•Cr2O3)冶炼制取金属铬的工艺流程如图所示__________________________ 。
②“水浸”要获得浸出液的操作是_________________________________ 。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为___ 。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是_______ 。
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5mol∙L-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=_______________ 。
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr +2H+
+2H+ Cr2
Cr2 + H2O)。
+ H2O)。______ 极(填“正”或“负”) , b 极发生的电极反应式为_________________ 。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是_______________ mol 。
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72—还原为Cr3+。该反应的离子反应方程式为
(2)利用铬铁矿(FeO•Cr2O3)冶炼制取金属铬的工艺流程如图所示

②“水浸”要获得浸出液的操作是
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是
(3)已知 Cr3+完全沉淀时溶液pH为5,(Cr3+浓度降至10-5mol∙L-1可认为完全沉淀)则Cr(OH)3的溶度积常数 Ksp=
(4)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr
 +2H+
+2H+ Cr2
Cr2 + H2O)。
+ H2O)。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是
您最近一年使用:0次
2019-05-28更新
|
760次组卷
|
4卷引用:陕西省汉中中学2021-2022学年高二下学期5月月考化学试题
解题方法
10 . 一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:

回答下列问题:
(1)步骤①焙烧的目的是_________________________________ 。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________ 。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________ 。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________ 。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________ 。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________ (填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________ 。

回答下列问题:
(1)步骤①焙烧的目的是
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为
您最近一年使用:0次
2018-12-04更新
|
511次组卷
|
3卷引用:【校级联考】陕西省汉中市重点中学2019届高三下学期开学联考理科综合化学试题



