解题方法
1 . 甘肃矿产资源丰富,金属冶炼在国民经济发展中有着重要的作用。锰酸锂鲤离子蓄电池是第二代锂离子动力电池,工业上用某软锰矿(主要成分为 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂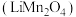 ,流程如图所示:
,流程如图所示:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 元素位于元素周期表中的
元素位于元素周期表中的_______ 区。
(2)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是_______ (写一条即可)。
(3)“还原”步骤得到的溶液中阳离子主要是 ,生成
,生成 的离子方程式为
的离子方程式为_______ ;滤渣1的主要成分为_______ 。
(4)已知某离子浓度[用 表示]形成沉淀与溶液
表示]形成沉淀与溶液 的关系如下图所示:
的关系如下图所示: 调节
调节 的范围是
的范围是_______ 。
(5)“沉锰”得到的是 和
和 滤饼,所得滤液回收可用于
滤饼,所得滤液回收可用于_______ 。
(6)“锂化”是将 和
和 按
按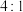 的物质的量比配料,球磨
的物质的量比配料,球磨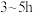 ,然后升温至
,然后升温至 ,保温
,保温 ,自然冷却至室温得产品,写出化学反应方程式:
,自然冷却至室温得产品,写出化学反应方程式:_______ 。
 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂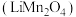 ,流程如图所示:
,流程如图所示:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 元素位于元素周期表中的
元素位于元素周期表中的(2)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(3)“还原”步骤得到的溶液中阳离子主要是
 ,生成
,生成 的离子方程式为
的离子方程式为(4)已知某离子浓度[用
 表示]形成沉淀与溶液
表示]形成沉淀与溶液 的关系如下图所示:
的关系如下图所示: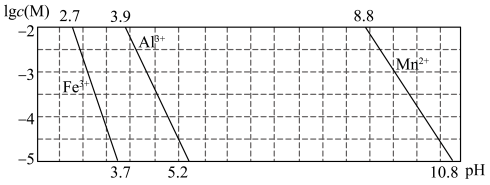
 调节
调节 的范围是
的范围是(5)“沉锰”得到的是
 和
和 滤饼,所得滤液回收可用于
滤饼,所得滤液回收可用于(6)“锂化”是将
 和
和 按
按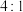 的物质的量比配料,球磨
的物质的量比配料,球磨 ,然后升温至
,然后升温至 ,保温
,保温 ,自然冷却至室温得产品,写出化学反应方程式:
,自然冷却至室温得产品,写出化学反应方程式:
您最近一年使用:0次
2 .  催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化的
催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化的 作催化剂,
作催化剂, 将
将 还原成
还原成 的一种反应历程如图所示。下列说法错误的是
的一种反应历程如图所示。下列说法错误的是
 催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化的
催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化的 作催化剂,
作催化剂, 将
将 还原成
还原成 的一种反应历程如图所示。下列说法错误的是
的一种反应历程如图所示。下列说法错误的是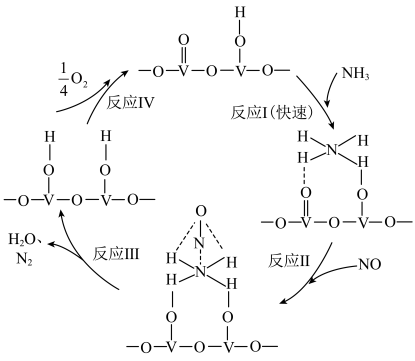
| A.该历程中能垒最高的是反应I |
| B.该历程中,V元素被氧化的只有反应Ⅳ |
C.该催化反应的总反应式为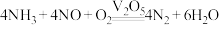 |
| D.整个历程中涉及极性键和非极性键的断裂和形成 |
您最近一年使用:0次
3 . 下列叙述对应的离子方程式正确的是
A.向 溶液中滴加稀氨水: 溶液中滴加稀氨水: |
B.向苯酚钠溶液中通入少量CO2: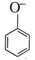 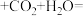 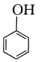 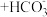 |
C.酸性 溶液氧化 溶液氧化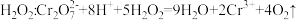 |
D. 溶液与过量 溶液与过量 溶液反应: 溶液反应: |
您最近一年使用:0次
名校
解题方法
4 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: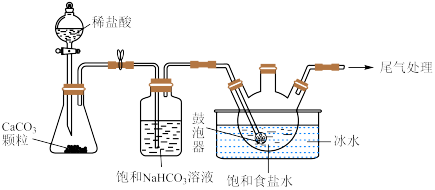
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
287次组卷
|
5卷引用:甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题
名校
5 . 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
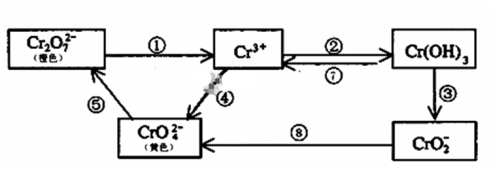
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式: _____Cr2O72-+ Fe3O4 + H+ → Cr3+ + Fe3+ + H2O,_________________
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为____________________ ;
②滴定时加入的指示剂通常为________________ ,滴定至终点的现象是________________ ;
③Na2S2O3溶液的物质的量浓度为_____________________ (保留四位有效数字)。

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式: _____Cr2O72-+ Fe3O4 + H+ → Cr3+ + Fe3+ + H2O,
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为
②滴定时加入的指示剂通常为
③Na2S2O3溶液的物质的量浓度为
您最近一年使用:0次



