名校
解题方法
1 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: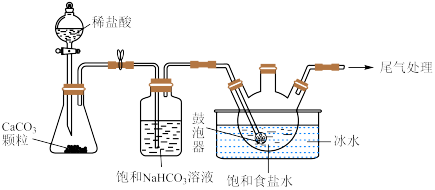
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近半年使用:0次
2024-03-30更新
|
260次组卷
|
5卷引用:甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题
2 . 化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋( ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是________ (填序号)。
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用________ (填序号)来鉴别,若白色固体是结晶苏打,观察到的现象是________ 。
(3)酸性 和
和 会发生如下反应:
会发生如下反应:______
________ ________
________ ________
________ ________
________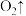 (配平上述方程式)。
(配平上述方程式)。
(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:________ 。
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:________ 。
①食盐(NaCl) ②食醋(
 ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用
(3)酸性
 和
和 会发生如下反应:
会发生如下反应:________
 ________
________ ________
________ ________
________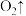 (配平上述方程式)。
(配平上述方程式)。(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:
您最近半年使用:0次
名校
3 . 84消毒液是常用消毒剂,主要成分为NaClO,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
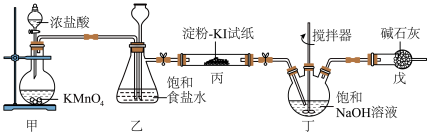
(1)装置甲中盛放浓盐酸的仪器名称是___________ ,装置甲中反应的离子方程式为___________ 。
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为___________ 。
(3)装置丁制备 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为___________ 。
(4)装置戊的作用是___________ 。
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为___________ ;猜测2可能为___________ 。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到___________ ,则证明猜测1正确。
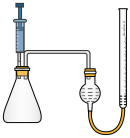

(1)装置甲中盛放浓盐酸的仪器名称是
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为
(3)装置丁制备
 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为(4)装置戊的作用是
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到

您最近半年使用:0次
2024-01-13更新
|
139次组卷
|
2卷引用:甘肃省酒泉市2023-2024学年高二上学期1月期末化学试题
解题方法
4 .  在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。
(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:___________ 。
___________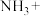 ___________
___________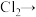 ___________
___________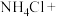 ___________
___________
(2)上述反应中的氧化产物为___________ (填化学式),氧化剂与还原剂的物质的量之比为___________ 。
(3)当生成1mol氮气时,被氧化的物质的质量为___________ ,反应中转移电子数为___________  。
。
(4)下列说法中正确的是___________(填字母)。
(5)已知:CuO能够和 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:___________ 。
 在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:
___________
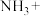 ___________
___________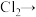 ___________
___________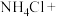 ___________
___________
(2)上述反应中的氧化产物为
(3)当生成1mol氮气时,被氧化的物质的质量为
 。
。(4)下列说法中正确的是___________(填字母)。
| A.上述反应中能观察到有白烟产生 |
| B.上述反应中生成的气体有刺激性气味 |
C. 不含金属阳离子,不属于盐类 不含金属阳离子,不属于盐类 |
| D.可用浓氨水来检验氯气管道是否泄漏 |
 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:
您最近半年使用:0次
解题方法
5 . 氯化亚铜(CuCl)是一种难溶于水的白色粉末,不溶于乙醇,可溶于浓盐酸和氨水,在潮湿空气中被氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。工业上常以海绵铜(主要成分是 Cu,含有少量CuO)为原料生产CuCl,其工艺流程如下:
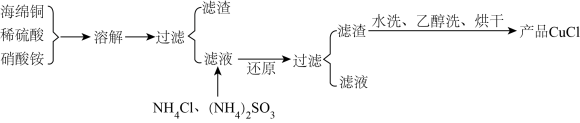
(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
____ Cu+___ +____  =
= _____ Cu2++____ NO↑ +___ H2O
(2)还原“”过程中,作还原剂的是_________ (填化学式);写出“还原”过程中发生反应的离子方程式:_________ 。
(3)写出氯化亚铜在潮湿的空气中被氧化的化学方程式:______ 。
(4)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,并在真空干燥机内于70℃下干燥2 h,冷却密封包装。密封包装的原因是______ 。

(1)配平“溶解”过程中发生的氧化还原反应的离子方程式:
 =
= (2)还原“”过程中,作还原剂的是
(3)写出氯化亚铜在潮湿的空气中被氧化的化学方程式:
(4)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,并在真空干燥机内于70℃下干燥2 h,冷却密封包装。密封包装的原因是
您最近半年使用:0次
名校
6 . 铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
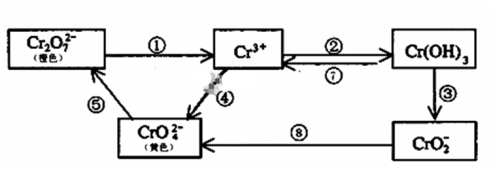
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式: _____Cr2O72-+ Fe3O4 + H+ → Cr3+ + Fe3+ + H2O,_________________
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:______________________
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为____________________ ;
②滴定时加入的指示剂通常为________________ ,滴定至终点的现象是________________ ;
③Na2S2O3溶液的物质的量浓度为_____________________ (保留四位有效数字)。

完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下,配平该离子反应方程式: _____Cr2O72-+ Fe3O4 + H+ → Cr3+ + Fe3+ + H2O,
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O ② 2S2O32- + I2→S4O62- + 2I- ,准确称取纯净的K2Cr2O7 0.294g ,配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为
②滴定时加入的指示剂通常为
③Na2S2O3溶液的物质的量浓度为
您最近半年使用:0次



