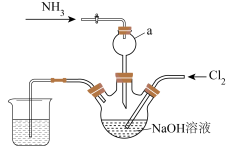
1 . 肼是一种火箭燃料。某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。相关物质的性质如下:
I.实验室制备N2H4_____________ 。
(2)仪器a的作用是____________ 。
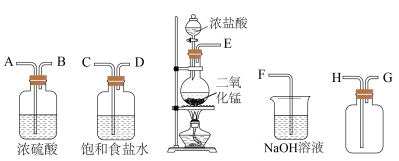
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→__________ →F(用字母表示)。___________ 。
Ⅱ.测定产品中水合腓(N2H4·H2O)的含量
(5)称取产品6.0g,加入通量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知: )。
)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为__________ 。
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用__________ 洗涤,检验洗涤是否完成的操作为____________ 。
物质 | 性状 | 熔点/℃ | 沸点/℃ | 性质 |
N2H4 | 无色液体 | 1.4 | 113 | 与水混溶,有强还原性 |
N2H6SO4 | 无色晶体 | 254 | - | 不溶于75%的乙醇溶液 |
(2)仪器a的作用是
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→
Ⅱ.测定产品中水合腓(N2H4·H2O)的含量
(5)称取产品6.0g,加入通量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:
 )。
)。①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用
您最近半年使用:0次
2024-04-29更新
|
129次组卷
|
2卷引用:甘肃省靖远县2024届高三下学期第三次联考化学试题
解题方法
2 . 无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。
(1)氯化炉中 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ ;炉气中残余的少量 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为___________ 。
(2)700℃时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)___________ 。
A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是___________ 。
(4)为测定制得的无水 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
①上述除杂过程中涉及的离子方程式为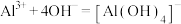 、
、___________ 。
②无水 产品的纯度为
产品的纯度为___________ 。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: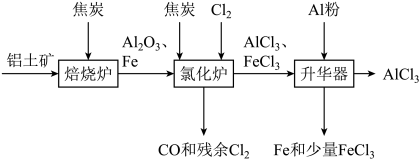
 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。(1)氯化炉中
 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为(2)700℃时,升华器中物质经充分反应后需降温实现
 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是
(4)为测定制得的无水
 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。①上述除杂过程中涉及的离子方程式为
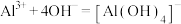 、
、②无水
 产品的纯度为
产品的纯度为
您最近半年使用:0次
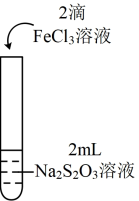
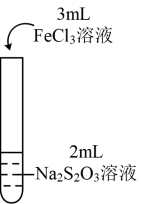
3 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢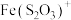 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应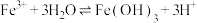
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢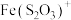 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应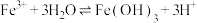
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近半年使用:0次
解题方法
4 . 三氯化锑( )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图: 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;
②常温下, 、
、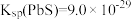 ;
;
③溶液中离子浓度小于或等于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有___________ (填一条即可)。
(2)“滤渣1”的主要成分有___________ (写化学式)。
(3)“浸出液”中加入适量 的目的是
的目的是___________ (填化学方程式)。
(4)当 、
、 共沉淀时,溶液中
共沉淀时,溶液中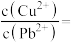
___________ (保留两位有效数字)。
(5)“除砷”时,氧化产物为 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为___________ 。
(6)已知:“电解” 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有___________ 。
(7) 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在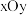 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则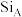 位于晶胞的
位于晶胞的___________ (填“面心”或“棱心”),晶体的密度为___________  。
。
 )用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为
)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为 ,还含有
,还含有 、
、 、
、 和
和 等)为原料制备
等)为原料制备 的工艺流程如图:
的工艺流程如图:
 具有强氧化性,“浸出液”主要含盐酸和
具有强氧化性,“浸出液”主要含盐酸和 ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;②常温下,
 、
、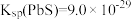 ;
;③溶液中离子浓度小于或等于
 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。回答下列问题:
(1)除将辉锑矿粉碎外,还能加快辉锑矿“酸浸”速率的措施有
(2)“滤渣1”的主要成分有
(3)“浸出液”中加入适量
 的目的是
的目的是(4)当
 、
、 共沉淀时,溶液中
共沉淀时,溶液中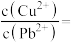
(5)“除砷”时,氧化产物为
 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为(6)已知:“电解”
 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有(7)
 晶体中
晶体中 原子沿z轴方向在
原子沿z轴方向在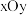 平面的投影图(即俯视图)如图,其中O原子略去,
平面的投影图(即俯视图)如图,其中O原子略去, 原子旁标注的数字表示每个
原子旁标注的数字表示每个 原子位于z轴的高度,则
原子位于z轴的高度,则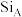 位于晶胞的
位于晶胞的 。
。
您最近半年使用:0次
解题方法
5 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
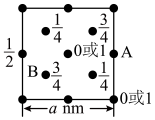
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
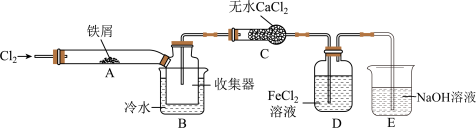
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近半年使用:0次
解题方法
6 . 某消毒液的主要成分为NaClO,还含有一定量的NaCl和NaOH。下列用来解释事实的离子方程式不合理的是
A.该消毒液可用NaOH溶液吸收 来制备: 来制备: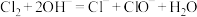 |
B.HClO的酸性弱于 : :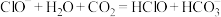 |
C.该消毒液与洁厕灵(主要成分为HCl)混用会产生有毒的 : : |
D.该消毒液加白醋会生成HClO,可增强漂白作用: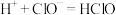 |
您最近半年使用:0次
解题方法
7 . 向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜,其反应过程如图所示。下列说法不正确 的是
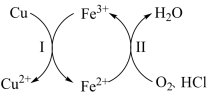

A.制备 的总反应为 的总反应为 |
B.反应Ⅰ中 作氧化剂 作氧化剂 |
C.反应Ⅱ中 作还原剂 作还原剂 |
D.还原性: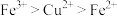 |
您最近半年使用:0次
解题方法
8 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近半年使用:0次
2024-03-23更新
|
49次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题
9 . 对于反应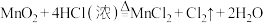
(1)MnO2在反应中电子____________ (填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(2)HCl在反应中____________ 电子(填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(3)配平下列化学方程式:
________ 
________ 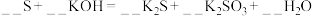
(4)用双线桥表示下列氧化还原反应。
①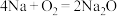
____________
②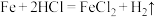
____________
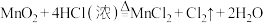
(1)MnO2在反应中电子
(2)HCl在反应中
(3)配平下列化学方程式:

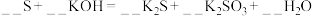
(4)用双线桥表示下列氧化还原反应。
①
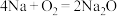
②
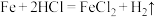
您最近半年使用:0次
解题方法
10 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(主要是 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
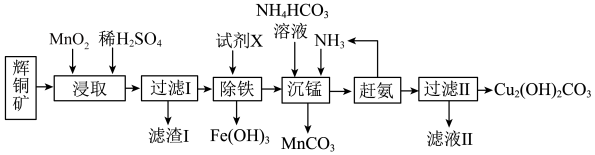
(1)Cu位于元素周期表第______ 周期第______ 族。
(2)滤渣Ⅰ经 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于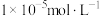 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用______ (写化学式),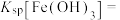
______ 。
(4)实验室检验碱式碳酸铜是否洗净的操作为______ 。
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
请根据原子结构分析Cu的第二电离能比Zn的第二电离能大的原因:______ 。
 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
(1)Cu位于元素周期表第
(2)滤渣Ⅰ经
 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于
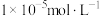 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用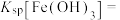
(4)实验室检验碱式碳酸铜是否洗净的操作为
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
元素 | 第一电离能/( | 第二电离能/( |
Cu | 746 | 1958 |
Zn | 906.4 | 1733 |
您最近半年使用:0次
2024-03-11更新
|
170次组卷
|
2卷引用:甘肃省白银市名校2023-2024学年高三下学期联合调研化学试题

 )
)

