1 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示:
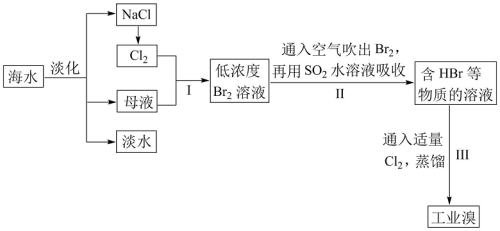
(1)请列举海水淡化的一种方法:___________
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是___________
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为___________ ,由此反应可知,除保护环境外,在工业生产中还应解决的问题是___________ 。

(1)请列举海水淡化的一种方法:
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,其目的是
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为
您最近半年使用:0次
2021-10-23更新
|
275次组卷
|
3卷引用:甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科B卷)化学试题
甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科B卷)化学试题甘肃省临夏县中学2020-2021学年高一下学期期末考试(理科A卷)化学试题(已下线)8.1 自然资源的开发利用——同步学习必备知识
名校
2 . 已知反应:
①SO2+2Fe3++2H2O→SO +2Fe2++W
+2Fe2++W
②Cr2O +aFe2++bH+→Cr3++Fe3++H2O
+aFe2++bH+→Cr3++Fe3++H2O
下列有关说法正确的是( )
①SO2+2Fe3++2H2O→SO
 +2Fe2++W
+2Fe2++W②Cr2O
 +aFe2++bH+→Cr3++Fe3++H2O
+aFe2++bH+→Cr3++Fe3++H2O下列有关说法正确的是( )
| A.还原性: SO2>Cr3+ |
| B.方程式②中,a=6,b=7 |
C.Cr2O 能将Na2SO3氧化成Na2SO4 能将Na2SO3氧化成Na2SO4 |
| D.方程式①中W为OH- |
您最近半年使用:0次
2020-09-10更新
|
406次组卷
|
15卷引用:甘肃省临夏回族自治州临夏中学2020届高三上学期期中考试化学试题
甘肃省临夏回族自治州临夏中学2020届高三上学期期中考试化学试题(已下线)2014届高考化学二轮复习江苏专用 第3讲两种重要的化学反应练习卷江西省金溪县第一中学2018届高三9月(三周考)月考化学试题福建省莆田第六中学2018届高三上学期期中考试化学试题B卷福建省莆田第六中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】陕西省渭南中学2019届高三上学期第三次质量检测化学试题陕西省西安市远东第一中学2019届高三上学期10月月考化学试题云南省泸西县一中2018-2019学年高一上学期期中考试化学试题(已下线)2019年7月18日 《每日一题》2020届高考一轮复习—— 氧化还原反应的配平宁夏青铜峡市高级中学(吴忠中学分校)2020届高三上学期第二次月考化学试题陕西省渭南市澄城县城关中学2019-2020学年高二检测化学试题鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 专题4 氧化还原反应的计算及方程式的配平黑龙江省伊春市伊美区第二中学2021届高三上学期开学考试化学试题河北省张家口市崇礼区第一中学2021届高三上学期期中考试化学试题
名校
解题方法
3 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
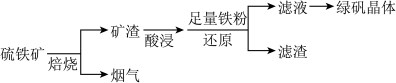
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式________ 。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式________ 。
(3)滤液中金属阳离子的检验方法__________ 。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由________ 。(结合化学用语说明原因)
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
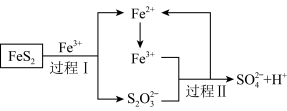
已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整______ FeS2+______ Fe3++_______ ______ =7Fe2++______ S2O32-+____ ______
②过程II反应的离子方程式________________________________________ 。
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为______________ 。(FeSO4·7H2O摩尔质量为278 g/mol)

(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(3)滤液中金属阳离子的检验方法
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+
①将过程I离子方程式补充完整
②过程II反应的离子方程式
(6)绿矾晶体在空气中易被氧化。取X g样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液b mL。反应原理:6Fe2++Cr2O72-+14H+ =6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近半年使用:0次
名校
4 . 以铬矿石(主要成分为Cr2O3,还有Al2O3、SiO2等杂质)为原料制取红矾钠 (Na2Cr2O7·2H2O)的流程如图所示。

已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+ Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012
(1)“煅烧”时,Cr2O3参加反应的化学方程式为_____ 。若“煅烧”操作最适宜的温度是800~900℃,则在实验室中进行此项操作时,应选择_____ 坩埚(填字母)。
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有_____ (填化学式)。
(3)“过滤II”所得沉淀主要有______ (填化学式)。
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有_____ ,经洗涤、干燥得到红矾钠样品。
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为____ 。若初始加入电解池中的c (Na2CrO4)=1.0mol·L-l,随着“电解”的进行,当溶液pH=6时,Na2CrO4的转化率为______ (忽略电解过程中溶液体积变化)。


已知:I.Cr2O3在碱性条件下易被氧化;
II.高温条件下,Al2O3与Na2CO3发生的反应为:Al2O3 +Na2CO3=2NaAlO2 +CO2↑;
III.2CrO42-+2H+
 Cr2O72- +H2O K=1.0×1012
Cr2O72- +H2O K=1.0×1012(1)“煅烧”时,Cr2O3参加反应的化学方程式为
a.陶瓷 b.玻璃 c.石英 d.铁
(2)流程中可循环利用的物质除CO2外还有
(3)“过滤II”所得沉淀主要有
(4)由Na2Cr2O7溶液制备红矾钠的具体实验操作有
(5)“电解”时,利用以下装置将Na2CrO4溶液转化为Na2Cr2O7溶液,当a、b均为石墨电极时,a电极的电极反应式为

您最近半年使用:0次
2019-10-13更新
|
478次组卷
|
4卷引用:甘肃省临夏回族自治州临夏中学2020届高三上学期期中考试化学试题
名校
5 . 以氯酸钠等为原料制备亚氯酸钠的工艺流程如下,下列说法错误的是
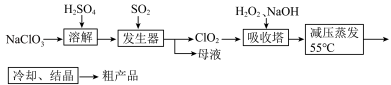

| A.NaClO3在发生器中作氧化剂 |
| B.吸收塔中1mol H2O2得到2mol电子 |
| C.吸收塔中温度不宜过高,会导致H2O2的分解 |
| D.从“母液”中可回收的主要物质是Na2SO4 |
您最近半年使用:0次
2019-03-16更新
|
1055次组卷
|
9卷引用:甘肃省临夏回族自治州临夏中学2020届高三上学期期中考试化学试题
6 . 市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)____ KIO3+___ KI+___ H2SO4=___ K2SO4+___ I2+___ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是__________________________________ 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作是______________________ 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________ 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是_______ mg/kg(以含w的代数式表示)。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作是
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取12.7g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为6.0×10-4mol·L-1的Na2S2O3溶液20.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②根据以上实验和包装袋说明,所测精制盐的碘含量是
您最近半年使用:0次
名校
7 . H2O2既可以作氧化剂,又可以作还原剂。现向H2O2溶液中加入强酸酸化的KMnO4溶液,紫红色的KMnO4溶液变成了无色。该强酸性反应体系中,反应物和生成物共六种粒子:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。
(1)写出该反应离子方程式并配平:____________________________________________________________________ 。
(2)该反应应选择的酸是:________________ (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目__________________ 。

(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为_________ L。
(1)写出该反应离子方程式并配平:
(2)该反应应选择的酸是:
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(3)请将氧化剂与还原剂的化学式填入空格中,并标出电子转移的方向和数目

(4)如反应中电子转移了0.5 mol,则产生的气体在标准状况下的体积为
您最近半年使用:0次
名校
解题方法
8 . 汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3―→K2O+Na2O+N2↑。对上述反应的描述错误的是
| A.NaN3是还原剂,KNO3是氧化剂 |
| B.该反应中有两种元素的化合价发生变化 |
| C.配平后物质的系数依次为 10、2、1、5、16 |
| D.若生成 8 mol N2,则转移电子的物质的量为 5 mol |
您最近半年使用:0次
2017-10-13更新
|
214次组卷
|
5卷引用:甘肃省临夏中学2018届高三上学期期中考试化学试题
甘肃省临夏中学2018届高三上学期期中考试化学试题陕西省西安中学2018届高三10月月考化学试题陕西省西安中学2018届高三上学期期中考试化学试题(已下线)学科网2019年高考化学一轮复习讲练测2.4 氧化还原反应的规律及应用 练山西省实验中学2018届高三上学期学业质量监测化学试题



