名校
解题方法
1 . X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
(1)X和W的元素符号分别为___ 、___ 。
(2)X与Y形成的原子个数比为2∶1的化合物中,Y原子最外层为8电子结构,请写出该化合物的电子式___ ,工业合成Y的氢化物的化学方程式为___ 。
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是___ 。此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为___ 。
| 元素 | 相关信息 |
| X | X的单质为密度最小的气体 |
| Y | Y的氢化物的水溶液呈碱性 |
| Z | Z是地壳中含量最高的元素 |
| W | W的一种核素的质量数为35,中子数为18 |
(2)X与Y形成的原子个数比为2∶1的化合物中,Y原子最外层为8电子结构,请写出该化合物的电子式
(3)X和Z组成的化合物中,既含有极性共价键又含有非极性共价键的是
您最近半年使用:0次
名校
解题方法
2 . 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,图为以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①Na2CO3+Al2O3 2NaAlO2+CO2↑;②Cr2O
2NaAlO2+CO2↑;②Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。
根据题意回答下列问题:
(1)已知焙烧时FeO·Cr2O3转化为Na2CrO4和Fe2O3,写出焙烧时反应的化学方程式_______ 。焙烧时要将铬铁矿石粉碎的目的是_______ 。
(2)固体X中主要含有_______ (填写化学式);酸化步骤用醋酸调节溶液pH<5,其目的是_______ 。
(3)写出生成Y的离子方程式_______ 。
(4)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是_______ 。
(5)操作Ⅲ由多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体._______ 、_______ 、过滤、洗涤、干燥。

已知:①Na2CO3+Al2O3
 2NaAlO2+CO2↑;②Cr2O
2NaAlO2+CO2↑;②Cr2O +H2O
+H2O 2CrO
2CrO +2H+。
+2H+。根据题意回答下列问题:
(1)已知焙烧时FeO·Cr2O3转化为Na2CrO4和Fe2O3,写出焙烧时反应的化学方程式
(2)固体X中主要含有
(3)写出生成Y的离子方程式
(4)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度(g/100 g水) | 0 ℃ | 28 | 35.7 | 4.7 | 163 |
| 40 ℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
您最近半年使用:0次
名校
解题方法
3 . 某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如图:(已知乳酸酸性强于碳酸)
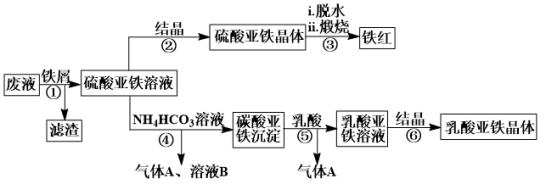
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO ;
;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为___ ,分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是___ ;步骤②中得到纯净硫酸亚铁晶体的操作为蒸发浓缩、___ 、___ 。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为___ 。
(3)步骤④的离子方程式是___ 。
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)__ 。

已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO
 ;
;②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2•xH2O↓+H2SO4。
请回答:
(1)步骤①所得滤渣的主要成分为
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(3)步骤④的离子方程式是
(4)实验室中常用KMnO4滴定法测定晶体中FeSO4·7H2O的质量分数,取步骤②中所得FeSO4·7H2O晶体样品ag,配成500.00mL溶液,取出25.00mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000mol•L-1KMnO4溶液25.00mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)
您最近半年使用:0次
2021-09-07更新
|
259次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三下学期四模考试化学试题
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
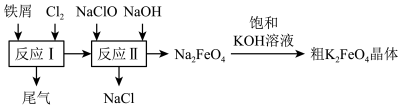
下列叙述错误的是

下列叙述错误的是
| A.该生产条件下,物质的溶解性:Na2FeO4> K2FeO4 |
| B.可用FeCl2溶液作为反应I中尾气吸收剂,且反应后溶液能在上述流程中利用 |
| C.反应II中氧化剂与还原剂的物质的量之比为2∶3 |
| D.用K2FeO4对饮用水杀菌消毒的同时可产生胶体吸附杂质净化水 |
您最近半年使用:0次
2020-12-14更新
|
310次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题
名校
5 . 关于如图所示的转化过程的分析错误的是
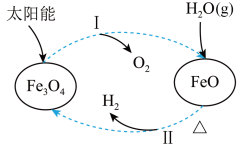
| A.Fe3O4中铁元素的化合价为+2、+3 |
| B.过程Ⅰ中每消耗58g Fe3O4转移1mol电子 |
C.过程Ⅱ中化学方程式为3FeO+H2O(g) Fe3O4+H2 Fe3O4+H2 |
| D.该过程总反应为2H2O(g)=O2+2H2 |
您最近半年使用:0次
2020-10-10更新
|
592次组卷
|
16卷引用:甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题
甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题2019年陕西省汉中市高考第一次模拟化学试题山东济宁市兖州区2020届高三网络模拟考试化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(一)菏泽一中2020届高三3月份化学质量检测肥城一中2020届高三3月份在线检测化学试题上海市建平中学2021届高三上学期9月月考化学试题山东省济钢高级中学2021届高三10月质量检测化学试题高一必修第一册(苏教2019)专题4 专题综合检测卷福建省长泰县第一中学2021届高三上学期11月考试化学试题(已下线)第12周 晚练题-备战2022年高考化学周测与晚练(新高考专用)河北师范大学田家炳中学2020-2021学年高一上学期第3次月考化学试题江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题江苏省无锡市辅仁高级中学2023-2024学年高一上学期期末复习化学模块综合试卷(一)11.2024年苏州木渎高级中学高一3月月考江苏省苏州第十中学校2023-2024学年高一下学期3月月考化学试题
名校
解题方法
6 . 氧化还原反应是一类重要的化学反应,在工农业生产、日常生活中都有广泛的用途。亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应: 2NaNO2+4HI=2NO↑+2NaI+I2+2H2O
(1)用双线桥法标出该反应中电子转移的方向及数目:_______ ,被氧化的原子与被还原的原子数目之比为______ 。
(2)自来水中的 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。
____ Al+___  +
+_____ =____  +
+____ N2↑+____
(1)用双线桥法标出该反应中电子转移的方向及数目:
(2)自来水中的
 对人类健康会产生危害,碱性条件下用Al粉还原
对人类健康会产生危害,碱性条件下用Al粉还原 ,产物是N2,发生的反应可表示如下,完成方程式并配平。
,产物是N2,发生的反应可表示如下,完成方程式并配平。 +
+ +
+
您最近半年使用:0次
2020-09-16更新
|
248次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷
名校
7 . MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:
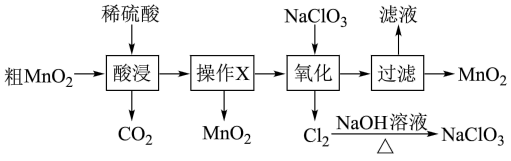
下列说法错误的是

下列说法错误的是
| A.酸浸过程中可以用浓盐酸代替稀硫酸 |
| B.操作X的名称是过滤 |
C.氧化过程发生反应的离子方程式为:5Mn2++2ClO +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 |
您最近半年使用:0次
2020-08-24更新
|
1488次组卷
|
9卷引用:甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题
甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题广东省惠州市2021届高三上学期第一次调研考试化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅱ卷)甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
名校
8 . 元素铬(Cr)在自然界主要以+3价和+6价存在。回答下列问题:
(1)+6价的Cr能引起细胞变异而对人体不利,可用Na2SO3将Cr2O72-还原为Cr3+,反应的离子方程式为____________________ 。
(2)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
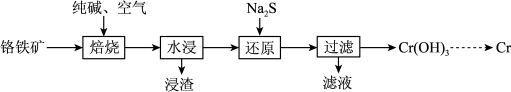
①为加快焙烧速率和提高原料的利用率,可采取的措施是_________ (写一条)。
②“水浸”后,要获得浸出液的操作是_______ 。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为______ 。
③加热Cr(OH)3可得到Cr2O3。从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是_________ 。
(1)+6价的Cr能引起细胞变异而对人体不利,可用Na2SO3将Cr2O72-还原为Cr3+,反应的离子方程式为
(2)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施是
②“水浸”后,要获得浸出液的操作是
③加热Cr(OH)3可得到Cr2O3。从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是
您最近半年使用:0次
2019-10-12更新
|
271次组卷
|
2卷引用:甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题
名校
9 . 某离子反应涉及到 H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确 的是
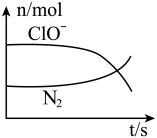

| A.该反应中Cl-为还原产物 |
| B.氧化剂与还原剂物质的量比为3:2 |
| C.消耗1 mol还原剂,转移6 mol电子 |
| D.氧化性:ClO-比 N2强 |
您最近半年使用:0次
2019-07-02更新
|
970次组卷
|
11卷引用:甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷
甘肃省嘉峪关市第一中学2021届高三上学期一模考试化学试卷福建省莆田第六中学2018-2019学年高一(实验班)下学期期中考试化学试题福建省莆田第六中学2018-2019学年高一下学期期中考试化学试题(已下线)2019年10月6日《每日一题》必修1 —— 每周一测甘肃省兰州第一中学2019-2020学年高一上学期期中考试化学试题上海市格致中学2020届高三上学期开学考试化学试题鲁科版(2019)高一必修第一册第二章B 素养拓展区 过素养 学科素养拓展训练高一必修第一册(苏教2019版)专题3 B 素养拓展区 过素养 学科素养拓展训练辽宁省沈阳市东北育才学校2020届高三上学期第一次模拟考试化学试题湖北省十堰市第二中学2021-2022学年高一上学期12月考试化学试题福建省宁德博雅培文学校2022-2023学年高一上学期线上期末考试化学试题
名校
解题方法
10 . 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
② Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O―→
H2O―→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________ 。
(2)上述反应①中氧化剂为______ ,被氧化的物质是______ 。若有2 mol Na2FeO2生成,则反应①中有________ mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________ (填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________ 。
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②
 Na2FeO2+
Na2FeO2+ NaNO2+
NaNO2+ H2O―→
H2O―→ Na2Fe2O4+
Na2Fe2O4+ NH3↑+
NH3↑+ NaOH
NaOH③Na2FeO2+Na2Fe2O4+2H2O
 Fe3O4+4NaOH
Fe3O4+4NaOH请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为
(2)上述反应①中氧化剂为
(3)关于“发蓝”的过程,下列说法不正确的是
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是
您最近半年使用:0次
2017-10-17更新
|
506次组卷
|
4卷引用:甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题



