解题方法
1 . 无水 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。
(1)氯化炉中 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为___________ ;炉气中残余的少量 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为___________ 。
(2)700℃时,升华器中物质经充分反应后需降温实现 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)___________ 。
A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是___________ 。
(4)为测定制得的无水 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
①上述除杂过程中涉及的离子方程式为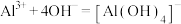 、
、___________ 。
②无水 产品的纯度为
产品的纯度为___________ 。
 可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是
可用作有机合成的催化剂、食品膨松剂等。工业上可由铝土矿(主要成分是 和
和 等)和焦炭制备,流程如下:
等)和焦炭制备,流程如下: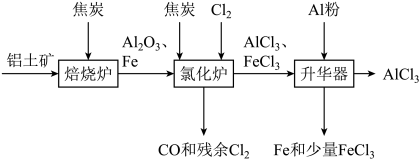
 、
、 分别在178℃,316℃时升华。
分别在178℃,316℃时升华。(1)氯化炉中
 、
、 和焦炭在高温下发生反应的化学方程式为
和焦炭在高温下发生反应的化学方程式为 可用NaOH溶液吸收,其离子方程式为
可用NaOH溶液吸收,其离子方程式为(2)700℃时,升华器中物质经充分反应后需降温实现
 和
和 的分离。请选择合适的温度范围:(填字母)
的分离。请选择合适的温度范围:(填字母)A.低于178℃ B.介于178℃和316℃之间 C.高于316℃
(3)升华器中发生反应的基本反应类型是
(4)为测定制得的无水
 产品(含杂质
产品(含杂质 )的纯度,称取16.25g无水
)的纯度,称取16.25g无水 样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。
样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.16g。①上述除杂过程中涉及的离子方程式为
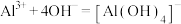 、
、②无水
 产品的纯度为
产品的纯度为
您最近一年使用:0次
2 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢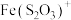 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应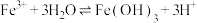
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢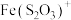 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近一年使用:0次
解题方法
3 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
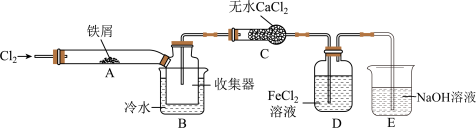
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近一年使用:0次
解题方法
4 . 某消毒液的主要成分为NaClO,还含有一定量的NaCl和NaOH。下列用来解释事实的离子方程式不合理的是
A.该消毒液可用NaOH溶液吸收 来制备: 来制备: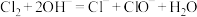 |
B.HClO的酸性弱于 : :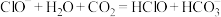 |
C.该消毒液与洁厕灵(主要成分为HCl)混用会产生有毒的 : : |
D.该消毒液加白醋会生成HClO,可增强漂白作用: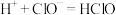 |
您最近一年使用:0次
解题方法
5 . 向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜,其反应过程如图所示。下列说法不正确 的是
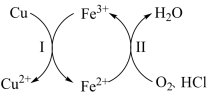

A.制备 的总反应为 的总反应为 |
B.反应Ⅰ中 作氧化剂 作氧化剂 |
C.反应Ⅱ中 作还原剂 作还原剂 |
D.还原性: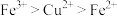 |
您最近一年使用:0次
解题方法
6 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近一年使用:0次
2024-03-23更新
|
52次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题
名校
解题方法
7 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。根据所学知识,回答下列问题:
(1)实验室加热亚硝酸铵(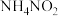 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为________ ,被氧化的氮原子与被还原的氮原子的物质的量之比为________ 。
(2)氨气还原氧化铜也可制得氮气,实验装置如图。
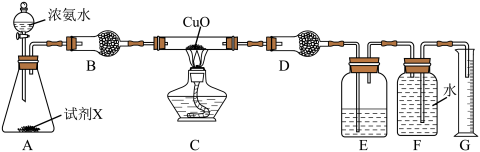
①试剂X为________ 。
②装置B的作用为________ 。
③氨气易溶于水,氨水呈碱性,其原因是________ (用离子方程式表示)。
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为________ ,反应的化学方程式为________ 。
(1)实验室加热亚硝酸铵(
 )的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为
)的浓溶液可制得氮气,同时可得到一种无色无味的液体,则反应的化学方程式为(2)氨气还原氧化铜也可制得氮气,实验装置如图。

①试剂X为
②装置B的作用为
③氨气易溶于水,氨水呈碱性,其原因是
④若在试管中进行氨气与红热的氧化铜反应的实验,可观察到的实验现象为
您最近一年使用:0次
解题方法
8 . 粗制的 中常含有杂质
中常含有杂质 。为了除去
。为了除去 ,加入少量的
,加入少量的 溶液,然后再调节溶液的
溶液,然后再调节溶液的 (常温下),可以完全除去铁离子而不损失铜离子。已知:常温下,离子浓度小于10-5时可以认为离子沉淀完全。下列说法错误的是
(常温下),可以完全除去铁离子而不损失铜离子。已知:常温下,离子浓度小于10-5时可以认为离子沉淀完全。下列说法错误的是
 中常含有杂质
中常含有杂质 。为了除去
。为了除去 ,加入少量的
,加入少量的 溶液,然后再调节溶液的
溶液,然后再调节溶液的 (常温下),可以完全除去铁离子而不损失铜离子。已知:常温下,离子浓度小于10-5时可以认为离子沉淀完全。下列说法错误的是
(常温下),可以完全除去铁离子而不损失铜离子。已知:常温下,离子浓度小于10-5时可以认为离子沉淀完全。下列说法错误的是A.常温下 |
B.调节pH时,加入的可能是 、NaOH、KOH、 、NaOH、KOH、 |
C.加入 溶液的目的是将 溶液的目的是将 氧化成 氧化成 : : |
D.将除铁后的溶液蒸发浓缩、冷却结晶、过滤洗涤、干燥,即可得到纯净的 |
您最近一年使用:0次
名校
9 . 三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料(含有少量铁、铝等杂质)生产NiCl2,继而生产Ni2O3的工艺流程如下:
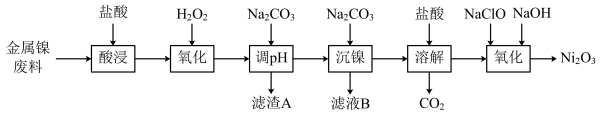
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
回答下列问题:
(1)Ni2O3中Ni元素的化合价为___________ ;为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:___________ (任写一种)。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是___________ (用语言叙述)。
(3)“沉镍”前需加Na2CO3控制溶液pH范围为___________ ;滤渣A为___________ 。
(4)“氧化”时生成Ni2O3的离子方程式为___________ 。
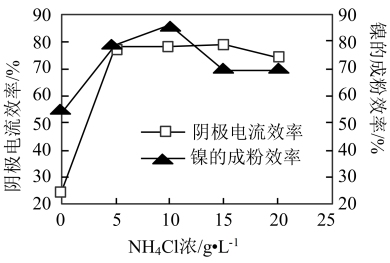
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为_______ 。

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)Ni2O3中Ni元素的化合价为
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加Na2CO3控制溶液pH范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则NH4Cl的浓度最好控制为

您最近一年使用:0次
2021-11-24更新
|
591次组卷
|
3卷引用:甘肃省白银市会宁县2021-2022学年高二上学期期末质量检测化学试题
名校
解题方法
10 . 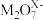 与S2-能在酸性溶液中反应:
与S2-能在酸性溶液中反应: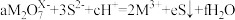 ,则
,则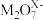 中M的化合价为
中M的化合价为
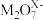 与S2-能在酸性溶液中反应:
与S2-能在酸性溶液中反应: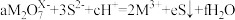 ,则
,则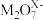 中M的化合价为
中M的化合价为| A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2021-11-04更新
|
268次组卷
|
13卷引用:2015-2016学年甘肃省会宁一中高一上期末考试化学试卷
2015-2016学年甘肃省会宁一中高一上期末考试化学试卷(已下线)2011-2012学年河北省衡水中学高一上学期期末考试化学试卷2014-2015四川省广安市高一期末考试化学试卷(已下线)2013-2014山西省大同一中高一12月月考化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2016-2017学年广东省普宁一中高二上第二次月考化学试卷2016-2017学年安徽省六安一中高一上阶段测二化学卷黑龙江省哈尔滨市第六中学2017-2018学年高一上学期期中考试化学试题【市级联考】河南省信阳市2018-2019学年高一上学期期中联考化学试题【全国百强校】湖北省孝感市高级中学2018-2019学年高一上学期期中考试化学试题黑龙江省大庆市第一中学高中化学必修一第二章 第三节 氧化还原第3课时(习题课)山西省应县第一中学2021-2022学年高一第二次月考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题