名校
解题方法
1 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(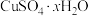 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: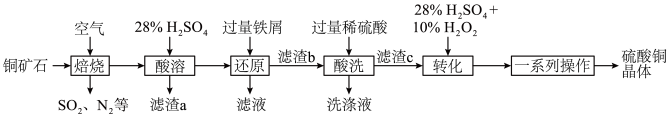
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
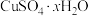 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。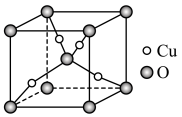
您最近半年使用:0次
今日更新
|
22次组卷
|
2卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
解题方法
2 . 粉煤灰是燃煤产生的工业固体废料,主要成分有 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
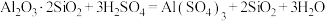

(1)“结晶”操作:缓缓加热,浓缩至___________ ,放置冷却,得到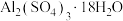 。
。
(2)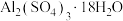 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
___________ 。
(3)“还原焙烧”过程中发生反应的化学方程式为___________ 。
(4)设计实验检验粗氧化铝中是否含有 :
:___________ 。
(5)向硅酸钠溶液中通入过量 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为___________ 。
 、
、 ,还含有少量
,还含有少量 、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下: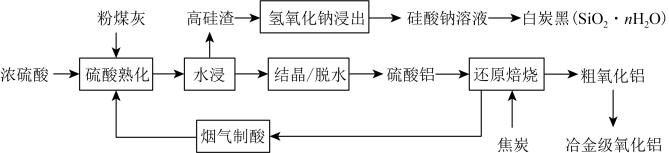
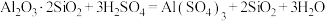

(1)“结晶”操作:缓缓加热,浓缩至
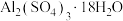 。
。(2)
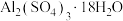 在250~300℃下失重40.5%得
在250~300℃下失重40.5%得 ,
,
(3)“还原焙烧”过程中发生反应的化学方程式为
(4)设计实验检验粗氧化铝中是否含有
 :
:(5)向硅酸钠溶液中通入过量
 制备白炭黑的化学方程式为
制备白炭黑的化学方程式为
您最近半年使用:0次
解题方法
3 . 过氧乙酸( )是无色透明液体,常用于速效漂白和消毒,氧化性比
)是无色透明液体,常用于速效漂白和消毒,氧化性比 强,与酸性
强,与酸性 相近。某课外实验小组同学用
相近。某课外实验小组同学用 溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
溶液与乙酸酐制备高浓度过氧乙酸并对其含量测定,实验过程如下。
 。
。Ⅰ.过氧化氢的浓缩:
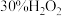 溶液浓缩至75%(
溶液浓缩至75%( 沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):
沸点150.2℃):浓缩装置如下图所示(连接用橡胶管和支持仪器以及抽气泵已省略):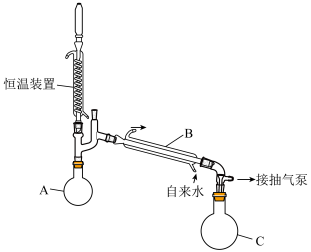
 溶液主要在
溶液主要在(2)该实验过程操作的正确顺序是
_______→_______→_______→_______→③→④
①水浴加热;②连接装置;③抽真空后向冷凝管中通水;
④自滴液漏斗往烧瓶中缓慢滴加
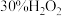 溶液;
溶液;⑤在滴液漏斗中装入
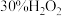 溶液;
溶液;⑥检查装置气密性。
Ⅱ.过氧乙酸的制备:如下图所示,搅拌器不断搅拌下,向三颈烧瓶中加入45mL乙酸酐,逐步滴加
 溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。
溶液25mL(过量),再加1mL浓硫酸,搅拌4小时,室温静置15小时即得47%的过氧乙酸溶液。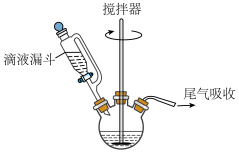
(4)实验中,利用搅拌器充分搅拌的作用是
(5)乙酸酐与
 反应的尾气可以用
反应的尾气可以用Ⅲ.过氧乙酸(含杂质)的含量测定:取适量样品按下图所示步骤依次进行实验,测定过氧乙酸的含量。

 溶液恰好除尽
溶液恰好除尽 的实验现象是
的实验现象是②第3步中过氧乙酸可被
 还原为乙酸,其离子方程式为
还原为乙酸,其离子方程式为③若实验中所取样品体积为
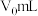 ,第3步中加入
,第3步中加入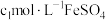 溶液
溶液 ,第4步滴定中消耗
,第4步滴定中消耗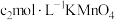 溶液
溶液 ,则过氧乙酸含量为
,则过氧乙酸含量为 。
。
您最近半年使用:0次
解题方法
4 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。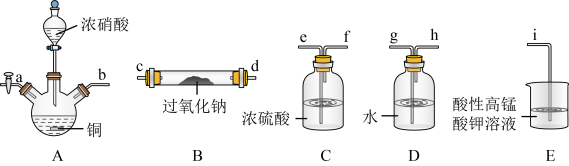
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近半年使用:0次
解题方法
5 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用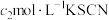 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,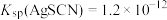 ,
,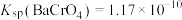 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。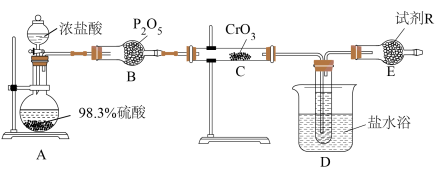
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
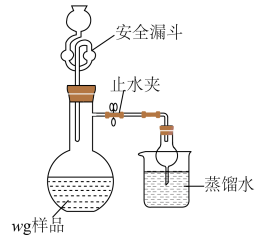
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用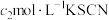 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,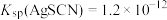 ,
,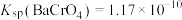 。
。
您最近半年使用:0次
名校
解题方法
6 . 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。
回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有___________ 因素。
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
分析表中数据,温度越高钡的浸出率越低的可能原因是___________ ;判断“浸取”的最佳液固比为___________ 。
(3)常温时,几种金属离子沉淀的pH如图所示,加 时发生反应的离子方程式为
时发生反应的离子方程式为___________ ;“调pH(Ⅰ)”时,调节溶液 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为___________ (填化学式)。___________ 。
 ,还含有
,还含有 及含Ca、Mg、Fe、Al的化合物)为原料制备
及含Ca、Mg、Fe、Al的化合物)为原料制备 的工艺流程如下:
的工艺流程如下: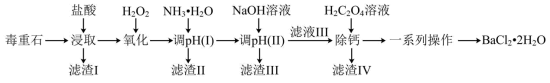
 、
、 、
、 、
、 形式存在于溶液中。
形式存在于溶液中。回答下列问题:
(1)在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有
(2)下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:
| 改变的条件 | 温度(℃) | 盐酸的浓度(%) | 液固比 | ||||||||
| 30 | 55 | 75 | 10 | 15 | 20 | 25 | 3:1 | 4:1 | 5:1 | 6:1 | |
| 钡的浸出率(%) | 74.31 | 69.60 | 68.42 | 59.21 | 74.31 | 74.15 | 55.32 | 59.84 | 65.12 | 74.31 | 74.35 |
(3)常温时,几种金属离子沉淀的pH如图所示,加
 时发生反应的离子方程式为
时发生反应的离子方程式为 ,则“滤渣Ⅱ”的主要成分为
,则“滤渣Ⅱ”的主要成分为
您最近半年使用:0次
名校
解题方法
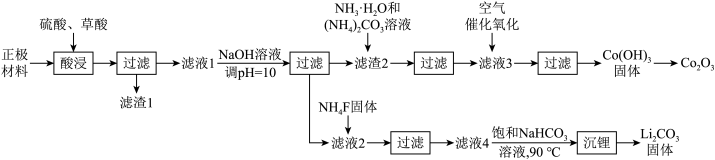
7 . 某化工厂利用废旧锂离子电池正极材料(含有LiCoO2以及少量Ca、Mg、Fe、Al等)制备Co2O3和Li2CO3.工艺流程如下: 如下表:
如下表:
②常温时, 的溶度积
的溶度积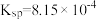 ,该数值随温度升高而减小。
,该数值随温度升高而减小。
(1)LiCoO2中Co元素的化合价为___________ ;基态Co原子的价层电子表示式为___________ 。
(2)“酸浸”时发生反应: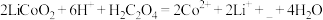 ,补充完整上述离子方程式
,补充完整上述离子方程式___________ 。
(3)已知滤渣2中含有 ,则常温下滤液2中
,则常温下滤液2中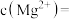
___________ mol/L。
(4)滤液3中含金属元素的离子主要是 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为___________ 。
(5)沉锂操作过程中的存在反应: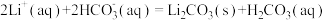 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是___________ 。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ ;
②设阿伏加德罗常数的值为 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ pm。
 如下表:
如下表:| 物质 |  |  |  |  |
 | 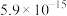 |  | 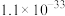 |  |
 的溶度积
的溶度积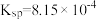 ,该数值随温度升高而减小。
,该数值随温度升高而减小。(1)LiCoO2中Co元素的化合价为
(2)“酸浸”时发生反应:
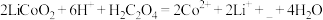 ,补充完整上述离子方程式
,补充完整上述离子方程式(3)已知滤渣2中含有
 ,则常温下滤液2中
,则常温下滤液2中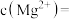
(4)滤液3中含金属元素的离子主要是
 ,通入空气发生催化氧化反应的离子方程式为
,通入空气发生催化氧化反应的离子方程式为(5)沉锂操作过程中的存在反应:
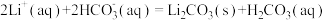 ,该操作中需将温度升高到90℃,原因是
,该操作中需将温度升高到90℃,原因是(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。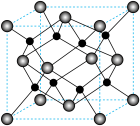
 在晶胞中的位置为
在晶胞中的位置为②设阿伏加德罗常数的值为
 。晶胞
。晶胞 的密度为b
的密度为b ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为
您最近半年使用:0次
解题方法
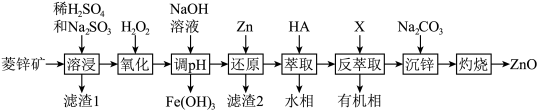
8 . ZnO是一种难溶于水的白色固体,在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上由菱锌矿(主要成分为ZnCO3、ZnO,还含有少量Ni2O3、FeO、MgCO3、PbO2等杂质)制备ZnO的工艺流程如图所示:
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为___________ 。
(2)滤渣1的化学式是___________ ,“溶浸”过程中Ni2O3发生反应的离子方程式是___________ 。
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是___________ (保留两位有效数字)。(已知:溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是___________ 。
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是___________ 。
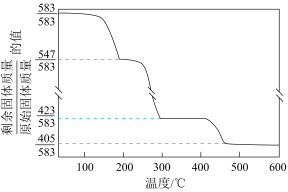
(5)在“沉锌”与“灼烧”之间进行的操作是___________ ,“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是___________ (填化学式)。
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为
(2)滤渣1的化学式是
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4
 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是(5)在“沉锌”与“灼烧”之间进行的操作是
您最近半年使用:0次
9 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备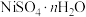 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)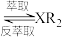 (有机相)
(有机相) (水相)
(水相)
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________ (填元素符号)。原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“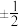 ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为________ 。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO________ MgO(填“>”“<”或“=”),理由是________ 。
(3)滤渣1的主要成分为________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是________ 。
(5)反萃取剂A为________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、________ 、过滤、洗涤、干燥。
 、
、 、
、 、
、 和
和 等]中回收制备
等]中回收制备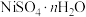 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)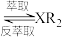 (有机相)
(有机相) (水相)
(水相)回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“ ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、
您最近半年使用:0次
名校
解题方法
10 . 以方铅矿(主要含PbS、FeS2、ZnS)和软锰矿(主要含MnO2、SiO2及铁的氧化物)为原料联合制取PbSO4和Mn3O4的一种流程示意图如下: [PbCl4]2- (aq) △H > 0
[PbCl4]2- (aq) △H > 0
(1)“酸浸”过程使矿石中的金属元素浸出,铅和锰分别以[PbCl4]2-和Mn2+的形式浸出。
① 加快浸出速率可采取的措施有___________ (写出2条)。
② 补全PbS与MnO2反应的离子方程式___________ 。
PbS +MnO2 +___________+___________= [PbCl4]2- +SO +___________+___________
+___________+___________
③ 加酸时,方案1:将盐酸一次性加入,硫元素主要转化为S单质;方案2:将盐酸间隔一定时间分两次加入,硫元素主要转化为SO ,该工艺流程采用方案2,理由是
,该工艺流程采用方案2,理由是___________ 。
(2)“除铁”时,加入NaOH至溶液pH≈3,过量的软锰矿将Fe2+氧化生成沉淀,写出发生反应的离子方程式___________ 。
(3)滤渣D的主要成分是PbS和ZnS,滤液C中c(Pb2+) = 7.7×10-7 mol·L-1,c(Zn2+) = 1.3×10-6 mol·L-1,则可推断Ksp(PbS)、Ksp(ZnS)、Ksp(MnS)的大小关系为___________ 。
(4)“氧化”过程,生成Mn3O4时参加反应的氧化剂与还原剂的物质的量之比为___________ (Mn3O4的结构式为 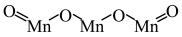 )。
)。
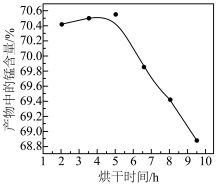
(5)干燥温度为90℃,对产品Mn3O4进行鼓风烘干,得到的产物中锰含量结果如图所示,5 h后随干燥时间的延长,产品中的锰含量下降的原因可能是___________ 。
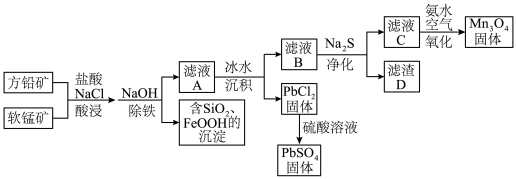
 [PbCl4]2- (aq) △H > 0
[PbCl4]2- (aq) △H > 0(1)“酸浸”过程使矿石中的金属元素浸出,铅和锰分别以[PbCl4]2-和Mn2+的形式浸出。
① 加快浸出速率可采取的措施有
② 补全PbS与MnO2反应的离子方程式
PbS +MnO2 +___________+___________= [PbCl4]2- +SO
 +___________+___________
+___________+___________③ 加酸时,方案1:将盐酸一次性加入,硫元素主要转化为S单质;方案2:将盐酸间隔一定时间分两次加入,硫元素主要转化为SO
 ,该工艺流程采用方案2,理由是
,该工艺流程采用方案2,理由是(2)“除铁”时,加入NaOH至溶液pH≈3,过量的软锰矿将Fe2+氧化生成沉淀,写出发生反应的离子方程式
(3)滤渣D的主要成分是PbS和ZnS,滤液C中c(Pb2+) = 7.7×10-7 mol·L-1,c(Zn2+) = 1.3×10-6 mol·L-1,则可推断Ksp(PbS)、Ksp(ZnS)、Ksp(MnS)的大小关系为
(4)“氧化”过程,生成Mn3O4时参加反应的氧化剂与还原剂的物质的量之比为
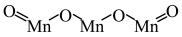 )。
)。(5)干燥温度为90℃,对产品Mn3O4进行鼓风烘干,得到的产物中锰含量结果如图所示,5 h后随干燥时间的延长,产品中的锰含量下降的原因可能是
您最近半年使用:0次




