解题方法
1 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为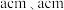 和
和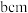 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为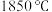 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
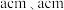 和
和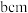 ,结构如下图所示。
,结构如下图所示。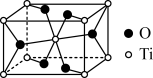
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
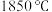 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
解题方法
2 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用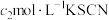 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,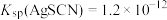 ,
,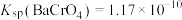 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。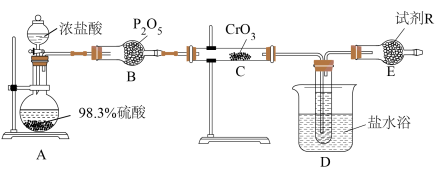
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
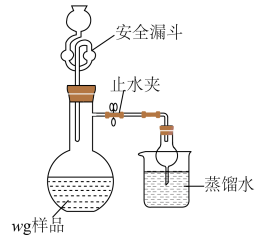
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用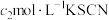 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,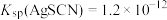 ,
,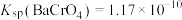 。
。
您最近半年使用:0次
3 . 近日,中科院上海硅酸盐研究所施剑林团队报道了MnOOH催化谷胱甘肽自氧化产生活性氧。某小组以菱锰矿(主要成分为 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下:
②几种金属离子沉淀的pH如表所示:
下列叙述正确的是
 ,含少量
,含少量 、FeO、CoO、
、FeO、CoO、 、
、 等)为原料制备高纯度MnOOH,流程如下:
等)为原料制备高纯度MnOOH,流程如下: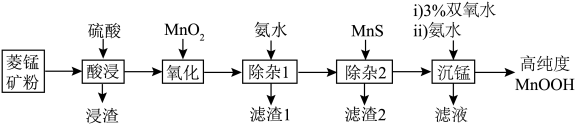
②几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |  |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.6 | 8.1 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.2 | 10.1 |
A.滤渣1的成分是 和 和 |
B.“氧化”反应的离子方程式为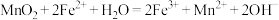 |
C.“除杂2”的原理是 |
D.双氧水氧化 ,滤液一定显酸性 ,滤液一定显酸性 |
您最近半年使用:0次
解题方法
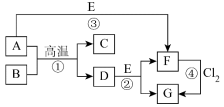
4 . 部分元素的单质及其化合物(或其溶液)的转化关系如图。已知A是生活中使用广泛的金属单质,常温下B是无色无味的液体,E是胃酸的主要成分。
(1)写出下列物质的化学式:E___________ ;G___________ 。
(2)反应①的化学方程式为___________ ;反应②的离子方程式为___________ 。
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为___________ (填离子符号),反应④中氧化剂和还原剂的物质的量之比为___________ 。
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为___________ (填化学式)。
(1)写出下列物质的化学式:E
(2)反应①的化学方程式为
(3)F溶液常温下呈浅绿色,该溶液中金属阳离子为
(4)Cl2通入到石灰乳中可以制成一种常用的消毒剂,其有效成分为
您最近半年使用:0次
解题方法
5 . 某离子反应涉及H2O、ClO-、 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
 、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是
、OH-、N2、Cl-等微粒,其中N2、ClO-的数目随时间变化的曲线如图所示,下列说法正确的是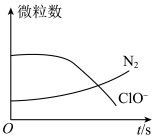
| A.该反应中Cl-为氧化产物 | B.消耗1mol还原剂微粒,转移6mol电子 |
C. 被ClO-氧化成N2 被ClO-氧化成N2 | D.该反应为非氧化还原反应 |
您最近半年使用:0次
6 . 由铁及其化合物可制得铁红(Fe2O3)、氧化铁、绿矾(FeSO4•7H2O)、高铁酸钾(K2FeO4)、铁黄(FeOOH)等物质。高铁酸钾是一种既能杀菌、消毒,又能絮凝净水的水处理剂,能与水反应生成氢氧化铁和氧气。铁黄可用作生产磁性材料、颜料的原料。工业制备K2FeO4的离子方程式为Fe(OH)3+ClO-+OH-→FeO +Cl-+H2O(未配平)。下列有关说法
+Cl-+H2O(未配平)。下列有关说法不正确 的是
 +Cl-+H2O(未配平)。下列有关说法
+Cl-+H2O(未配平)。下列有关说法| A.K2FeO4中Fe显+6价 |
B.ClO-的氧化性大于FeO |
| C.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| D.每1molK2FeO4与水反应,产生0.5molO2 |
您最近半年使用:0次
名校
解题方法
7 . 卤素互化物、拟卤素与卤素单质的结构,性质相似。常见的卤素互化物有ICl、IBr等,拟卤素有(CN)2、(SCN)2等。
(1)卤族元素位于元素周期表的_______ 。
(2)79Br和81Br这两种核素的中子数之差的绝对值为_______ 。
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为_______ 。
(4)①已知CN-与N2结构相似,CN-的电子式为______ 。
②推算HCN分子中σ键与π键数目之比为_______ 。
③关于氨基氰(N≡C-NH2)分子的说法中正确的是_______ 。
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为______ 。
(6)K2[Zn(CN)4]中Au+的配位数为______ 。
(7)i中反应的离子方程式为:_______ 。
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______
(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因_______ 。
(1)卤族元素位于元素周期表的
| A.s区 | B.p区 | C.d区 | D.f区 |
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
②推算HCN分子中σ键与π键数目之比为
③关于氨基氰(N≡C-NH2)分子的说法中正确的是
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为
(6)K2[Zn(CN)4]中Au+的配位数为
(7)i中反应的离子方程式为:
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因
您最近半年使用:0次
名校
解题方法
8 . 大量燃烧含硫量高的煤容易造成酸雨污染,因此,我国北方地区在采暖季全面推行“煤改气”,同时提高煤的脱硫效率,减少污染的排放。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】二氧化硫能使高锰酸钾溶液褪色(由紫色变为无色),该反应的物质变化过程为:SO2+KMnO4+H2O→K2SO4+MnSO4+H2SO4
(1)配平上述反应并用单线桥标出电子转移的方向和数目_______ 。
_______SO2+_______KMnO4+_______H2O=_______K2SO4+_______MnSO4+_______H2SO4
预测性质:二氧化硫和二氧化碳都是酸性氧化物,两者应具有相似的化学性质。
(2)设计实验:根据上述资料和预测,小组同学设计实验方案进行探究。
甲同学进行了如图所示A、B两步实验:
乙同学认为甲同学的实验方案不合理,其理由是:_______ 。
(3)丙同学进行了如图所示实验(部分装置在图中略去):
图B装置的作用是______ ;图C装置的作用是_______ 。图C装置中为什么需要使用浓度较高的高锰酸钾溶液?________ 。丙同学的实验能证明煤中含有硫和碳元素的现象是:_______ 。
【提出问题】通过实验证明煤中含有碳元素和硫元素。
【查阅资料】二氧化硫能使高锰酸钾溶液褪色(由紫色变为无色),该反应的物质变化过程为:SO2+KMnO4+H2O→K2SO4+MnSO4+H2SO4
(1)配平上述反应并用单线桥标出电子转移的方向和数目
_______SO2+_______KMnO4+_______H2O=_______K2SO4+_______MnSO4+_______H2SO4
预测性质:二氧化硫和二氧化碳都是酸性氧化物,两者应具有相似的化学性质。
(2)设计实验:根据上述资料和预测,小组同学设计实验方案进行探究。
甲同学进行了如图所示A、B两步实验:
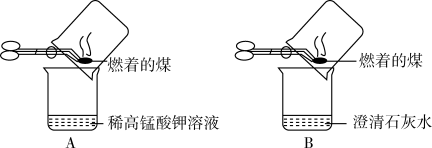
| 实验现象 | 实验结论 |
| A中稀高锰酸钾溶液褪色,B中澄清石灰水变浑浊。 | 煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。 |
(3)丙同学进行了如图所示实验(部分装置在图中略去):
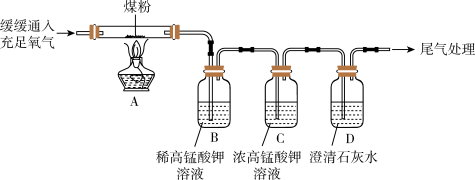
图B装置的作用是
您最近半年使用:0次
解题方法
9 . 利用硫酸烧渣(主要含Fe2O3、FeO,还含有SiO2和CuO等)来制取FeSO4溶液。
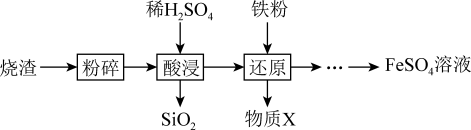
(1)“酸浸”时,Fe2O3发生反应的离子方程式是_______ 。
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是______ 。
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有_______ 。
②根据计算,选用的容量瓶规格应为______ 。
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O
①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是_______ 。
②试通过计算,求原FeSO4溶液的物质的量浓度是多少_______ ?(写出计算过程)

(1)“酸浸”时,Fe2O3发生反应的离子方程式是
(2)“还原”时,铁粉将Fe3+、Cu2+还原为Fe2+和Cu。检验Fe3+是否已全部被还原,所选用试剂的化学式是
(3)实验室测定FeSO4溶液的浓度,常用K2Cr2O7标准溶液进行滴定。现称量2.940gK2Cr2O7(M=294g•mol-1)固体,配制成0.0100mol•L-1K2Cr2O7标准溶液。
①称量时,需用到的仪器有

②根据计算,选用的容量瓶规格应为
A.100mL B.250mL C.500mL D.1000mL
(4)将(2)得到的FeSO4溶液进行下列操作,测定其物质的量浓度:
步骤一:取10.00mLFeSO4溶液,将其稀释成100.00mL溶液。
步骤二:取25.00mL稀释后的溶液,向其中加入0.100mol•L-1酸性KMnO4溶液。恰好反应时,记下消耗KMnO4溶液的体积。
步骤三:重复上述实验3次,平均消耗KMnO4溶液20.00mL。
已知:MnO
 +5Fe2++8H+=Mn2++5Fe3++4H2O
+5Fe2++8H+=Mn2++5Fe3++4H2O①“步骤一”中稀释时所用的水需先进行加热煮沸,其目的是
②试通过计算,求原FeSO4溶液的物质的量浓度是多少
您最近半年使用:0次
名校
10 . 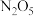 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成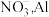 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮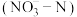 。完成下列填空:
。完成下列填空:
(1) 被
被 脱除,
脱除, 被还原成
被还原成 ,配平下列反应的离子方程式
,配平下列反应的离子方程式___________ 。
_______ _______
_______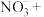 ________
________ ________
________ ________
________ ________
________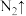
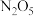 不稳定,时的分解方式如下:
不稳定,时的分解方式如下:
①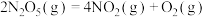
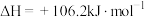 ;
;
②
 。
。
(2) 时,在一个容积不变的容器中加入
时,在一个容积不变的容器中加入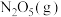 ,气体总浓度
,气体总浓度 与时间
与时间 的变化关系如下表所示:
的变化关系如下表所示:
①在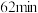 时,测得
时,测得 浓度为
浓度为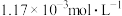 ,此时
,此时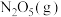 的浓度是
的浓度是___________  。反应达到平衡时,
。反应达到平衡时,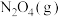 的浓度是
的浓度是___________  。
。
②若升温至 ,平衡时气体总浓度
,平衡时气体总浓度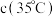
___________ 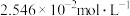 。
。
A.> B.= C.<
③已知:
___________ 。
④ 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。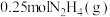 完全燃烧成
完全燃烧成 和
和 时,放出
时,放出 热量。请写出该反应的热化学方程式
热量。请写出该反应的热化学方程式___________ 。
(3)针对反应②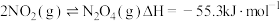 ,如图表示的
,如图表示的 的变化图。可见反应在
的变化图。可见反应在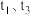 时都达到了平衡,而
时都达到了平衡,而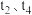 时都改变了个条件。
时都改变了个条件。
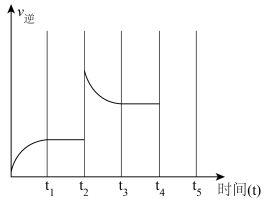
① 时扩大容器的体积,请在图中画出
时扩大容器的体积,请在图中画出 时逆反应的变化趋势
时逆反应的变化趋势___________ 。
②试判断 时可能改变的条件是
时可能改变的条件是___________ 。
(4)针对反应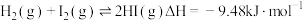
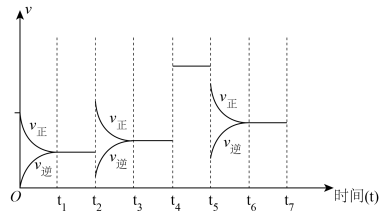
① 时可能改变的条件是
时可能改变的条件是___________ ;
② 时仅改变一个条件,可能是
时仅改变一个条件,可能是___________ 。
③ 时仅降低了反应的温度,可能原因是
时仅降低了反应的温度,可能原因是___________ 。
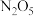 是硝酸的酸酐,溶于水生成
是硝酸的酸酐,溶于水生成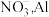 或
或 合金可用于还原脱除水体中的硝态氮
合金可用于还原脱除水体中的硝态氮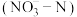 。完成下列填空:
。完成下列填空:(1)
 被
被 脱除,
脱除, 被还原成
被还原成 ,配平下列反应的离子方程式
,配平下列反应的离子方程式_______
 _______
_______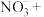 ________
________ ________
________ ________
________ ________
________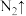
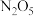 不稳定,时的分解方式如下:
不稳定,时的分解方式如下:①
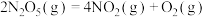
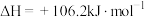 ;
;②

 。
。(2)
 时,在一个容积不变的容器中加入
时,在一个容积不变的容器中加入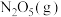 ,气体总浓度
,气体总浓度 与时间
与时间 的变化关系如下表所示:
的变化关系如下表所示: | 0 | 260 |  |
 |  |  |  |
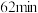 时,测得
时,测得 浓度为
浓度为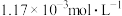 ,此时
,此时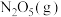 的浓度是
的浓度是 。反应达到平衡时,
。反应达到平衡时,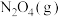 的浓度是
的浓度是 。
。②若升温至
 ,平衡时气体总浓度
,平衡时气体总浓度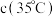
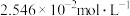 。
。A.> B.= C.<
③已知:

④
 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。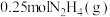 完全燃烧成
完全燃烧成 和
和 时,放出
时,放出 热量。请写出该反应的热化学方程式
热量。请写出该反应的热化学方程式(3)针对反应②
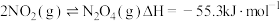 ,如图表示的
,如图表示的 的变化图。可见反应在
的变化图。可见反应在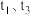 时都达到了平衡,而
时都达到了平衡,而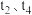 时都改变了个条件。
时都改变了个条件。
①
 时扩大容器的体积,请在图中画出
时扩大容器的体积,请在图中画出 时逆反应的变化趋势
时逆反应的变化趋势②试判断
 时可能改变的条件是
时可能改变的条件是(4)针对反应
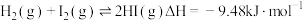

①
 时可能改变的条件是
时可能改变的条件是②
 时仅改变一个条件,可能是
时仅改变一个条件,可能是③
 时仅降低了反应的温度,可能原因是
时仅降低了反应的温度,可能原因是
您最近半年使用:0次



