名校
解题方法
1 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(4) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
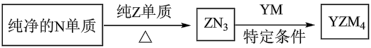
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:

②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(4)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次
解题方法
2 . A、B、C、D、E、F、G为中化学常见物质,它们之间有如图转化关系(反应条件已略去)。已知:A、C、D、E均含有同种非金属元素M,A为气态氢化物;G是一种紫红色的金属单质;B是空气的组成成分,在空气中占比约为21%。根据学知识,按要求回答下列问题:
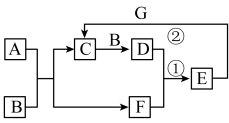
I.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为___________ 。
(2)写出反应②的化学方程式:________ ,该反应中体现了E的浓溶液的_________ 性。
(3)写出C与A反应的化学方程式___________ 。
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F三种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:___________ 。
(5)常温下,将60mLD与B的混合气体通入水中,充分反应后,剩余10mL无色气体,则60mL混合气体中B的体积可能为___________ mL(填标号)。
①6 ②10 ③16 ④20

I.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为
(2)写出反应②的化学方程式:
(3)写出C与A反应的化学方程式
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F三种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:
(5)常温下,将60mLD与B的混合气体通入水中,充分反应后,剩余10mL无色气体,则60mL混合气体中B的体积可能为
①6 ②10 ③16 ④20
您最近半年使用:0次
解题方法
3 . 下表是元素周期表中的一部分:
根据a~i在周期表中的位置,回答下列问题:
(1)a~i的单质中,化学性质最不活泼的是______ (填化学式,下同),氧化性最强的是_______ 。
(2)a与b形成的简单化合物的电子式是___________ 。
(3)最高价氧化物对应的水化物酸性最强的是___________ (填化学式);e、f的最高价氧化物对应的水化物之间反应的离子方程式为________________________ 。
(4)g的最高价氧化物对应水化物的浓溶液可与Cu在加热时反应,反应的化学方程式为___________________ ,该反应中氧化剂与还原剂的物质的量之比为_________ 。
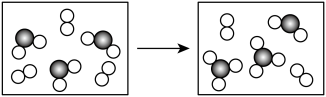
(5)如图表示由c、g元素组成的两种气体分子在一定 条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式:_______________________ 。
I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 第1周期 | a | |||||||
| 第2周期 | b | c | d | |||||
| 第3周期 | e | f | g | h | i | |||
(1)a~i的单质中,化学性质最不活泼的是
(2)a与b形成的简单化合物的电子式是
(3)最高价氧化物对应的水化物酸性最强的是
(4)g的最高价氧化物对应水化物的浓溶液可与Cu在加热时反应,反应的化学方程式为
(5)如图表示由c、g元素组成的两种气体分子在一定 条件下的密闭容器中充分反应的转化关系,请写出该转化过程的化学方程式:

您最近半年使用:0次
名校
4 . X、Y、Z、Q、W、R是常见的短周期主族元素,其相关信息如下表:
(1)元素X在元素周期表中的位置是_______ ,其氢化物X2H4使Br2/CCl4溶液褪色的反应方程式为_______ 。
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是_______ 。
(3)汽车尾气净化器可使XO与YO两种有毒气体催化转化后排放,化学反应方程式为_______ 。
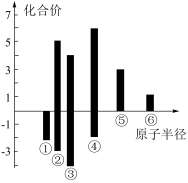
(4)上述六种元素原子半径与主要化合价的关系如图,其中X的单质与④最高价氧化物对应水化物浓溶液共热反应的还原产物为_______ 。
(5)为消除水体中含量过高的YQ ,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为_______ 。
元素 | 相关信息 |
X | 它的一种同位素被用作相对原子质量的标准 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 是短周期中原子半径最大的主族元素 |
Q | 最外层电子数是次外层电子数的3倍 |
W | 原子序数等于X、Y原子序数之和 |
R | 与Q同族,且最高价氧化物的水化物的浓溶液常温下使W单质钝化 |
(2)上述六种元素中有2种元素能形成一种淡黄色的固体化合物,该化合物的电子式是
(3)汽车尾气净化器可使XO与YO两种有毒气体催化转化后排放,化学反应方程式为
(4)上述六种元素原子半径与主要化合价的关系如图,其中X的单质与④最高价氧化物对应水化物浓溶液共热反应的还原产物为

(5)为消除水体中含量过高的YQ
 ,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
,可向水体中先加足量NaOH溶液再加W单质共热(有YH3生成),该反应的离子方程式为
您最近半年使用:0次
解题方法
5 . 从铝土矿废料“赤泥”(主要成分为Al2O3、Fe2O3、TiO2、Sc2O3)中提钪与TiO2的一种工艺如下:
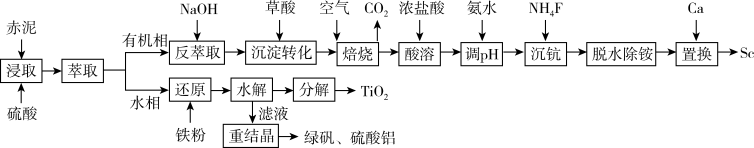
已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
(1)钪为21号元素,该元素在元素周期表中的位置是_______ 。
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是_______ 。
(3)“焙烧”过程中,生成Sc2O3的化学方程式为_______ 。
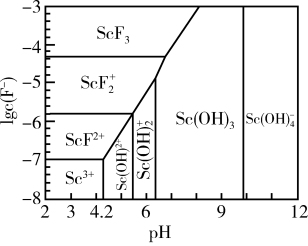
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为_______ (填化学式)。
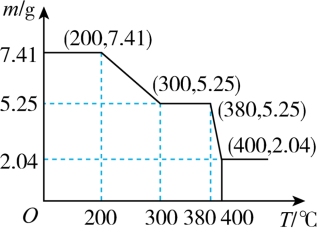
(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=_______ (填数字)。
(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为_______ ;应控制溶液的pH值为_______ 。

已知:该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的pH值如下表:
| 离子 | Fe2+ | Fe3+ | Al3+ | TiO2+ |
| 开始沉淀pH | 7.0 | 1.9 | 3.0 | 0.3 |
| 完全沉淀pH | 9.0 | 3.2 | 4.7 | 2.0 |
(1)钪为21号元素,该元素在元素周期表中的位置是
(2)“沉淀转化”过程中,需加入过量的草酸,其原因是
(3)“焙烧”过程中,生成Sc2O3的化学方程式为
(4)常温下,三价Sc的几种存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。已知c(F-)=1×10-5,“调pH”过程中控制pH=4.0,则调节pH值后三价Sc的存在形式为

(5)“脱水除铵”过程中,复盐3NH4Cl·ScF3·aH2O分解得到ScF3,某固体样品质量与温度的关系如图所示。加热至380-400℃产生白烟,400℃以上质量不再改变。则a=

(6)“水解”过程中,加水稀释后,TiOSO4水解为TiO2·xH2O的离子方程式为
您最近半年使用:0次
6 . 化合物A中含有三种元素,3.68gA在氧气中充分煅烧后生成1.28gB、1.60gC和气体D,物质A~H存在如图转化关系。
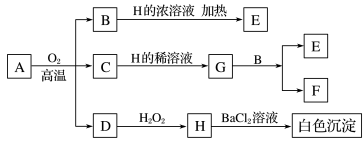
已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A中非金属元素在元素周期表中的位置为:___ ;
(2)检验气体D的实验方法:___ ;
(3)写出B与H的浓溶液反应的化学方程式:___ ;
(4)写出A在氧气中充分煅烧的化学方程式:___ 。

已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A中非金属元素在元素周期表中的位置为:
(2)检验气体D的实验方法:
(3)写出B与H的浓溶液反应的化学方程式:
(4)写出A在氧气中充分煅烧的化学方程式:
您最近半年使用:0次
7 . 氧化锌烟灰中主要含有锌、铅、铜、氧、砷、氯等元素。氨法溶浸氧化锌烟灰可制取高纯锌,工艺流程如图所示。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为____________ 。
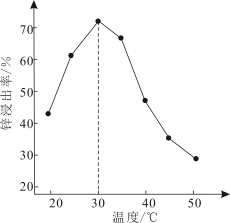
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为______________ 。
(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式__________________________________________ 。
(4)“滤渣3”除锌外,主要成分为___________________ 。
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是___________ (写名称)。电解后的电解液经补充_________ (写一种物质的化学式)后可返回至__________________ (填流程中的操作名称)循环利用。
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为_______________ 。

已知氧化锌烟灰经溶浸后,其中的锌、铅、铜、氧、砷元素不同程度的进入浸出液中,其中锌和砷元素分别以Zn(NH3)42+、AsCl52-的形式存在。
回答下列问题:
(1)Zn的原子序数为30,其在元素周期表中的位置为
(2)锌浸出率与温度的关系如图所示,分析30℃时锌浸出率最高的原因为

(3)“氧化除杂”中,AsCl52-转化为As2O5胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式
(4)“滤渣3”除锌外,主要成分为
(5)“电解”时阳极区放出一种无色无味的气体,将其通入滴有KSCN的FeCl2溶液中,无明显现象,该气体是
(6)ZnCl2溶液一次水解可获得产物Zn(OH)xCly,取10.64g该水解产物,经二次水解、缎烧后,可得氧化锌8.1g(假设各步均转化完全)。则一次水解产物的化学式为
您最近半年使用:0次
名校
解题方法
8 . 硒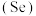 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为_______ 。
(2) 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
_______  (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是_______ ;热稳定性:
_______  。
。
(3)研究发现,给小鼠喂食适量硒酸钠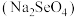 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。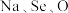 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为_______ 。
(4)反应物III的部分结构与肼 十分相似,
十分相似, 的电子式为
的电子式为_______ 。以 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼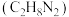 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为_______ 。
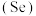 是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光
是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光 效应以来,
效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子IV的合成路线如下:
分子IV的合成路线如下: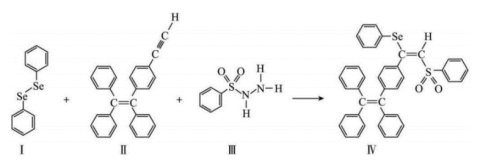
 与S同族,
与S同族, 在元素周期表中的位置为
在元素周期表中的位置为(2)
 是一种有恶臭的气体,常作半导体用料。与
是一种有恶臭的气体,常作半导体用料。与 相比,沸点
相比,沸点
 (填“>”或“<”,下同),原因是
(填“>”或“<”,下同),原因是
 。
。(3)研究发现,给小鼠喂食适量硒酸钠
 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。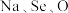 形成的简单离子的半径由大到小的顺序为
形成的简单离子的半径由大到小的顺序为(4)反应物III的部分结构与肼
 十分相似,
十分相似, 的电子式为
的电子式为 为原料合成的液体火箭燃料偏二甲肼
为原料合成的液体火箭燃料偏二甲肼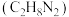 与液态氧化剂
与液态氧化剂 接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与
接触时立刻反应,产生大量无害气体,放出巨大能量,把火箭送上天空,偏二甲肼与 反应的化学方程式为
反应的化学方程式为
您最近半年使用:0次
2023-03-24更新
|
263次组卷
|
2卷引用:湖北省名校3月联考2022-2023学年高一下学期化学试题
9 . 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置___________
(2)过程Ⅰ中,在 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅰ中, 催化过程可表示为:
催化过程可表示为:
ⅰ: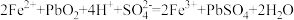
ⅱ:……
①写出ⅱ的化学方程式:___________ 。
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的 溶液中加入
溶液中加入___________ 溶液,溶液无颜色变化,再加入少量 ,溶液变为
,溶液变为___________ 色。
b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制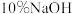 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有___________ (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;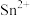 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:

①骤Ⅰ加入Sn粉的作用:___________ 。
②步骤Ⅳ中检验 是否洗涤干净的操作是
是否洗涤干净的操作是___________ ,证明已洗净。
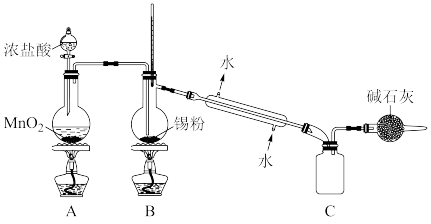
③实验室欲用下图装置制备少量 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是___________ ,装有碱石灰的球形干燥管的作用是___________ 。

(1)铅是碳的同族元素,且比碳多4个电子层,则铅在元素周期表中位置
(2)过程Ⅰ中,在
 催化下,Pb和
催化下,Pb和 反应生成
反应生成 的离子方程式是
的离子方程式是(3)过程Ⅰ中,
 催化过程可表示为:
催化过程可表示为:ⅰ:
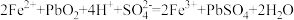
ⅱ:……
①写出ⅱ的化学方程式:
②请设计实验方案可证实上述催化过程。将实验方案补充完整。
a.向酸化的
 溶液中加入
溶液中加入 ,溶液变为
,溶液变为b.向a得到的溶液中加入Pb,溶液恢复原来的颜色。
(4)配制
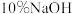 溶液时,所需玻璃仪器除量筒外还有
溶液时,所需玻璃仪器除量筒外还有A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.胶头滴管
(5)锡与铅同族,锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;
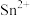 易水解、易被氧化;
易水解、易被氧化; 极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
极易水解、熔点为-33℃、沸点为114℃。用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如下:
①骤Ⅰ加入Sn粉的作用:
②步骤Ⅳ中检验
 是否洗涤干净的操作是
是否洗涤干净的操作是③实验室欲用下图装置制备少量
 (夹持装置略),该装置存在明显缺陷,改进方法是
(夹持装置略),该装置存在明显缺陷,改进方法是
您最近半年使用:0次
解题方法
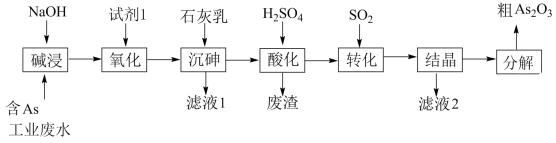
10 . 砷 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;
② 微溶于水,
微溶于水, 难溶于水。
难溶于水。
回答下列问题:
(1)砷元素在元素周期表中的位置为_______ 。
(2)“碱浸”中发生反应的离子方程式为_______ 。
(3)从绿色化学角度考虑,“试剂1”可以选择_______ (填化学式)。
(4)“沉砷”在流程中的目的是_______ ;“沉砷”的最佳温度是 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是_______ 。
(5)“废渣”的主要成分是_______ ,“转化”中发生反应的化学方程式为_______ 。
(6)从综合利用的角度考虑“滤液2”可返回_______ 步骤中循环再利用。
 在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗
在元素周期表中与氮同主族,砷及其化合物被运用在农药、医药和染料等领域中。某含砷工业废水经处理可转化为粗 ,流程如下:
,流程如下:
已知:
①含
 工业废水主要以亚砷酸(
工业废水主要以亚砷酸( )形式存在,
)形式存在, 为三元弱酸,受热分解为
为三元弱酸,受热分解为 ;
;②
 微溶于水,
微溶于水, 难溶于水。
难溶于水。回答下列问题:
(1)砷元素在元素周期表中的位置为
(2)“碱浸”中发生反应的离子方程式为
(3)从绿色化学角度考虑,“试剂1”可以选择
(4)“沉砷”在流程中的目的是
 ,温度高于
,温度高于 时,随温度升高转化率下降,可能的原因是
时,随温度升高转化率下降,可能的原因是(5)“废渣”的主要成分是
(6)从综合利用的角度考虑“滤液2”可返回
您最近半年使用:0次



