1 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式___________ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的 气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是___________ (用文字表述,任写一条合理途径)。
(3)某同学将足量的 通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
(4)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为___________ 。
②如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液___________ 、过滤洗涤、干燥等步骤。

(5)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油 (
(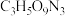 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为___________ ;
②实验室制备硝化甘油的化学方程式为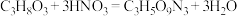 ,用足量浓硝酸、浓硫酸和
,用足量浓硝酸、浓硫酸和 mL
mL  g/cm
g/cm 甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为___________ 。

③反应得到16g硝化甘油,则产率为___________ (保留整数)。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的
 气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是(3)某同学将足量的
 通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。| A.硝酸钾溶液 | B.稀盐酸 | C.氨水 | D.硫化钠溶液 |
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(5)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(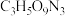 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
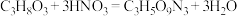 ,用足量浓硝酸、浓硫酸和
,用足量浓硝酸、浓硫酸和 mL
mL  g/cm
g/cm 甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
③反应得到16g硝化甘油,则产率为
您最近一年使用:0次
名校
2 . 氧化还原反应是一类重要的反应,在工农业生产、实验室、日常生活中都有广泛的用途。
(1)广西南宁隆安县是全国知名的火龙果种植基地,火龙果富含的花肝素能够消耗活性氧,说明花青素可以作为___________ 剂(填“氧化”或“还原”)。
(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转化装置。在催化转化器中,汽车尾气中的CO和NO在催化剂、高温条件下发生反应,生成两种无毒气体。请写出该反应的化学方程式___________ 。
(3) 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 和
和 反应的化学方程式
反应的化学方程式___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂B.作还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
(4)《天工开物》记载“凡火药以硝石、硫磺为主,草木灰为辅……魂散惊而魄齑粉”,其中涉及的主要反应为: ,该反应过程中转移6mol电子时,产生的
,该反应过程中转移6mol电子时,产生的 在标况下体积为
在标况下体积为___________ L。
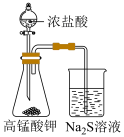
(5)实验室可以用高锰酸钾和浓盐酸反应制备氯气,请写出该反应的离子方程式:__________ 。现采用如图所示的装置探究物质氧化性强弱,若观察到右侧烧杯出现淡黄色沉淀,则说明 、
、 和S的氧化性由强到弱的顺序为:
和S的氧化性由强到弱的顺序为:___________ 。
(1)广西南宁隆安县是全国知名的火龙果种植基地,火龙果富含的花肝素能够消耗活性氧,说明花青素可以作为
(2)治理汽车尾气的一种方法是在汽车的排气管上装一个催化转化装置。在催化转化器中,汽车尾气中的CO和NO在催化剂、高温条件下发生反应,生成两种无毒气体。请写出该反应的化学方程式
(3)
 可在呼吸面具和潜水艇中作为氧气的来源,请写出
可在呼吸面具和潜水艇中作为氧气的来源,请写出 和
和 反应的化学方程式
反应的化学方程式 在该反应中
在该反应中A.作氧化剂B.作还原剂
C.既是氧化剂又是还原剂D.既不是氧化剂也不是还原剂
(4)《天工开物》记载“凡火药以硝石、硫磺为主,草木灰为辅……魂散惊而魄齑粉”,其中涉及的主要反应为:
 ,该反应过程中转移6mol电子时,产生的
,该反应过程中转移6mol电子时,产生的 在标况下体积为
在标况下体积为(5)实验室可以用高锰酸钾和浓盐酸反应制备氯气,请写出该反应的离子方程式:
 、
、 和S的氧化性由强到弱的顺序为:
和S的氧化性由强到弱的顺序为:
您最近一年使用:0次
3 .  在常温下为黄色气体,熔点为
在常温下为黄色气体,熔点为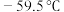 ,沸点为11℃,易溶于水其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应
,沸点为11℃,易溶于水其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应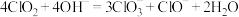 ,
, 的制备方法有多种。回答下列问题:
的制备方法有多种。回答下列问题:
(1)方法一:用氯酸钠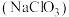 氧化浓盐酸,生成二氧化氯的同时会有氯气产生,请配平该反应的化学方程式:
氧化浓盐酸,生成二氧化氯的同时会有氯气产生,请配平该反应的化学方程式:_______ 。

方法二:在酸性条件下用氯酸钠溶液和 反应生成
反应生成 ,请配平该反应的离子方程式:
,请配平该反应的离子方程式:_______ 。

(2)一种有效成分为 、
、 、
、 的“二氧化氯泡腾片”溶于水时,逸出大量
的“二氧化氯泡腾片”溶于水时,逸出大量 ,同时
,同时 在酸性条件下发生自身氧化还原反应,得到
在酸性条件下发生自身氧化还原反应,得到 溶液。
溶液。
①上述反应产生大量 的离子方程式为
的离子方程式为_______ 。
②上述反应生成 离子方程式为
离子方程式为_______ 。
(3)实验室可用如图所示装置制备 (夹持装置略)
(夹持装置略)_______
②装置B收集 时,为了收集更多的
时,为了收集更多的 ,可采取的措施为
,可采取的措施为_______ (填一条)。
(4) 的稳定性较差,易分解,常用
的稳定性较差,易分解,常用 和
和 的混合溶液将其转化为
的混合溶液将其转化为 进行保存,参与反应的
进行保存,参与反应的 与
与 的个数比为
的个数比为_______ ,若加入过量的 可能导致的后果是
可能导致的后果是_______ 。
 在常温下为黄色气体,熔点为
在常温下为黄色气体,熔点为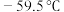 ,沸点为11℃,易溶于水其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应
,沸点为11℃,易溶于水其水溶液是一种广谱杀菌剂,在碱性环境中易发生反应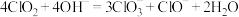 ,
, 的制备方法有多种。回答下列问题:
的制备方法有多种。回答下列问题:(1)方法一:用氯酸钠
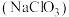 氧化浓盐酸,生成二氧化氯的同时会有氯气产生,请配平该反应的化学方程式:
氧化浓盐酸,生成二氧化氯的同时会有氯气产生,请配平该反应的化学方程式:
方法二:在酸性条件下用氯酸钠溶液和
 反应生成
反应生成 ,请配平该反应的离子方程式:
,请配平该反应的离子方程式:
(2)一种有效成分为
 、
、 、
、 的“二氧化氯泡腾片”溶于水时,逸出大量
的“二氧化氯泡腾片”溶于水时,逸出大量 ,同时
,同时 在酸性条件下发生自身氧化还原反应,得到
在酸性条件下发生自身氧化还原反应,得到 溶液。
溶液。①上述反应产生大量
 的离子方程式为
的离子方程式为②上述反应生成
 离子方程式为
离子方程式为(3)实验室可用如图所示装置制备
 (夹持装置略)
(夹持装置略)
②装置B收集
 时,为了收集更多的
时,为了收集更多的 ,可采取的措施为
,可采取的措施为(4)
 的稳定性较差,易分解,常用
的稳定性较差,易分解,常用 和
和 的混合溶液将其转化为
的混合溶液将其转化为 进行保存,参与反应的
进行保存,参与反应的 与
与 的个数比为
的个数比为 可能导致的后果是
可能导致的后果是
您最近一年使用:0次
解题方法
4 . 根据题中所给的信息,回答下列问题:
(1)目前,汽车尾气已成为城市空气的主要污染源,汽车尾气中含有CO、NO等多种污染物。治理汽车尾气中NO和CO的一种方法是:在汽车的排气管内装一个催化转化装置, 使NO与CO在催化剂的作用下发生反应,生成N2和CO2.请写出该反应的化学方程式___________ ,其中还原剂是___________ ,被还原的物质是___________ 。
(2)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如下图所示。
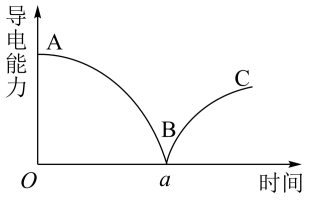
①Ba(OH)2溶液与稀硫酸反应的离子方程式为___________ 。
②该小组的同学关于上图的下列说法中,错误的是___________ 。
A.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和。
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子。
C.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质。
D.BC段溶液的导电能力不断增大,主要原因是存在Ba(OH)=Ba2++2OH-。
(3)高铁酸盐是常用的水处理剂。干法制备高铁酸钠(Na2FeO4)可利用Na2O2与FeSO4反应,产物还有硫酸钠、氧气和氧化钠,且反应时消耗的Na2O2与生成的O2的物质的量之比为4∶1。
①写出制备高铁酸钠反应的化学方程式___________ 。
②若生成1.12LO2(标准状况),则转移电子的数目为___________ 。
(1)目前,汽车尾气已成为城市空气的主要污染源,汽车尾气中含有CO、NO等多种污染物。治理汽车尾气中NO和CO的一种方法是:在汽车的排气管内装一个催化转化装置, 使NO与CO在催化剂的作用下发生反应,生成N2和CO2.请写出该反应的化学方程式
(2)某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如下图所示。

①Ba(OH)2溶液与稀硫酸反应的离子方程式为
②该小组的同学关于上图的下列说法中,错误的是
A.a时刻Ba(OH)2溶液与稀硫酸恰好完全中和。
B.B处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子。
C.AB段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质。
D.BC段溶液的导电能力不断增大,主要原因是存在Ba(OH)=Ba2++2OH-。
(3)高铁酸盐是常用的水处理剂。干法制备高铁酸钠(Na2FeO4)可利用Na2O2与FeSO4反应,产物还有硫酸钠、氧气和氧化钠,且反应时消耗的Na2O2与生成的O2的物质的量之比为4∶1。
①写出制备高铁酸钠反应的化学方程式
②若生成1.12LO2(标准状况),则转移电子的数目为
您最近一年使用:0次



