解题方法
1 . 溶液常 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
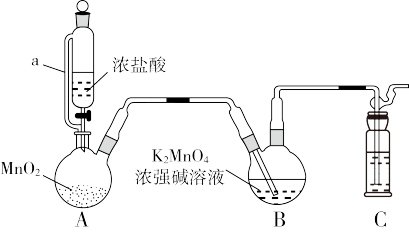
已知: 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: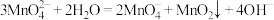
回答下列问题:
(1) 的化学名称为
的化学名称为_______ 。
(2)装置A中所发生反应的化学方程式为_______ ;其中a的作用是_______ 。
(3)装置C中盛装的试剂是_______ 。
(4)分析发现该装置有不足之处,改进的方法是_______ 。
(5)为测定某 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取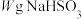 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取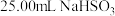 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为_______ , 固体的纯度为
固体的纯度为_______ 。
 用作氧化还原反应滴定的标准液,利用
用作氧化还原反应滴定的标准液,利用 氧化
氧化 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知:
 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: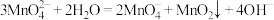
回答下列问题:
(1)
 的化学名称为
的化学名称为(2)装置A中所发生反应的化学方程式为
(3)装置C中盛装的试剂是
(4)分析发现该装置有不足之处,改进的方法是
(5)为测定某
 固体的纯度,现用
固体的纯度,现用 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: )称取
)称取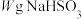 固体溶于水配成500mL溶液,取
固体溶于水配成500mL溶液,取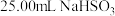 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液V mL。滴定终点的现象为
溶液V mL。滴定终点的现象为 固体的纯度为
固体的纯度为
您最近一年使用:0次
2022-11-15更新
|
168次组卷
|
2卷引用:河北省秦皇岛市青龙满族自治县2校联考2023-2024学年高一上学期12月月考化学试题
名校
解题方法
2 . 海洋是一个巨大的化学资源宝库,而溴又被称为“海洋元素”。以海水为原料制备溴的工艺流程如图所示,请回答下列问题。
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入__________ (填标号)后,过滤,往滤液中加入稍过量的稀盐酸,充分反应后加热除去HCl,获得精盐水。若过滤所得的滤液比较浑浊,原因可能是__________ 。
a.NaOH溶液、 溶液、
溶液、 溶液
溶液
b. 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液
c. 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液
d.KOH溶液、 溶液、
溶液、 溶液
溶液
(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为__________ ;步骤Ⅱ中反应的离子方程式为__________ 。
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是__________ (填标号);往2mL淀粉碘化钾溶液中,滴加几滴溴水,观察到的现象为__________ 。
(4)下列有关说法正确的是__________(填标号)。
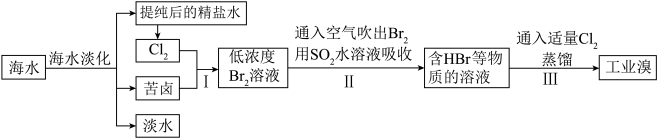
(1)海水晒盐所得的粗盐的主要成分为NaCl,还含有少量的
 、
、 和
和 。将粗盐溶于水后,依次加入
。将粗盐溶于水后,依次加入a.NaOH溶液、
 溶液、
溶液、 溶液
溶液b.
 溶液、KOH溶液、
溶液、KOH溶液、 溶液
溶液c.
 溶液、
溶液、 溶液、NaOH溶液
溶液、NaOH溶液d.KOH溶液、
 溶液、
溶液、 溶液
溶液(2)氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,该反应的化学方程式为
(3)往5mL溴水中,加入1mL四氯化碳,振荡、静置后,试管中的现象是
A. B.
B. C.
C. D.
D.
(4)下列有关说法正确的是__________(填标号)。
| A.步骤Ⅰ、Ⅱ的目的是富集溴元素 |
| B.精盐水中分散质的粒子直径介于1~100nm |
C.非金属性: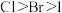 |
| D.实验室常将溴单质保存在带有橡胶塞的棕色广口瓶中,并加少量水水封 |
您最近一年使用:0次
名校
3 . 现取一定量的硫酸酸化的硫酸锰( )溶液,向其中依次加入下列试剂,对应的现象如下表所示:
)溶液,向其中依次加入下列试剂,对应的现象如下表所示:
已知:①金属铋(Bi)价态为+3价时较稳定,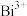 无色;
无色;
②铋酸钠( )无色,难溶于水;
)无色,难溶于水;
③淀粉溶液遇到 变成蓝色。
变成蓝色。
(1)由上述现象可得 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为___________ ;
(2)根据上述结论,请写出 与硫酸锰溶液在酸性条件下反应的离子方程式
与硫酸锰溶液在酸性条件下反应的离子方程式___________ ;
(3)硫酸酸化的 溶液和双氧水反应产生氧气,请将反应的化学方程式补充完整:
溶液和双氧水反应产生氧气,请将反应的化学方程式补充完整:_________

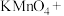



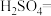



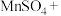

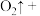

___________
(4)软锰矿的主要成分为 ,现以软锰矿和闪锌矿为原料制备单质Zn,在工艺流程中
,现以软锰矿和闪锌矿为原料制备单质Zn,在工艺流程中 和FeS发生反应,化学方程式为
和FeS发生反应,化学方程式为 。
。
①该反应中,氧化剂是___________ ,氧化产物是___________ 。
②用双线桥法标出该反应的电子转移情况:___________ 。
③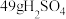 参加反应时转移电子的个数为
参加反应时转移电子的个数为___________ 。
 )溶液,向其中依次加入下列试剂,对应的现象如下表所示:
)溶液,向其中依次加入下列试剂,对应的现象如下表所示:| 试剂 | 少量铋酸钠 | 过量的双氧水 | 适量KI—淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
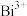 无色;
无色;②铋酸钠(
 )无色,难溶于水;
)无色,难溶于水;③淀粉溶液遇到
 变成蓝色。
变成蓝色。(1)由上述现象可得
 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)根据上述结论,请写出
 与硫酸锰溶液在酸性条件下反应的离子方程式
与硫酸锰溶液在酸性条件下反应的离子方程式(3)硫酸酸化的
 溶液和双氧水反应产生氧气,请将反应的化学方程式补充完整:
溶液和双氧水反应产生氧气,请将反应的化学方程式补充完整:
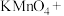



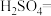



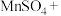

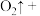

(4)软锰矿的主要成分为
 ,现以软锰矿和闪锌矿为原料制备单质Zn,在工艺流程中
,现以软锰矿和闪锌矿为原料制备单质Zn,在工艺流程中 和FeS发生反应,化学方程式为
和FeS发生反应,化学方程式为 。
。①该反应中,氧化剂是
②用双线桥法标出该反应的电子转移情况:
③
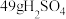 参加反应时转移电子的个数为
参加反应时转移电子的个数为
您最近一年使用:0次
2023-11-16更新
|
349次组卷
|
2卷引用:河北省邢台市第一中学2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
4 . 根据信息回答以下与元素相关的问题。
I.汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对其治理具有重要意义。
(1)氧化-还原法消除NOx的转化:NO NO2
NO2 N2
N2
①反应I为NO+O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子数目为___________ ;
②反应II中,当n(NO2):nCO(NH2)2=3:2时,氧化产物与还原产物的质量比为_________ ;
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置II中酸性条件下,NO被Ce4+氧化的产物主要是 、
、 ,写出生成等物质的量的
,写出生成等物质的量的 和
和 时的离子方程式
时的离子方程式________ 。
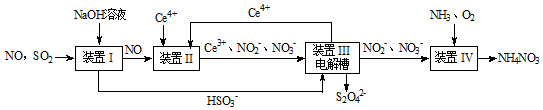
(3)已知进入装置IV的溶液中,NO2的浓度为a g/L,要使1m3该溶液中的 完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气
完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气______ L(用含a代数式表示,结果保留整数)。
II.镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_______ 。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应剧烈,原因是_______ 。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的固态化合物,Y、Z与水反应均可放出气体。0.01 mol Y溶于100 mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为______ ,Z的电子式为_______ 。
I.汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对其治理具有重要意义。
(1)氧化-还原法消除NOx的转化:NO
 NO2
NO2 N2
N2①反应I为NO+O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子数目为
②反应II中,当n(NO2):nCO(NH2)2=3:2时,氧化产物与还原产物的质量比为
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置II中酸性条件下,NO被Ce4+氧化的产物主要是
 、
、 ,写出生成等物质的量的
,写出生成等物质的量的 和
和 时的离子方程式
时的离子方程式
(3)已知进入装置IV的溶液中,NO2的浓度为a g/L,要使1m3该溶液中的
 完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气
完全转化为NH4NO3,至少需向装置IV中通入标准状况下的氧气II.镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的固态化合物,Y、Z与水反应均可放出气体。0.01 mol Y溶于100 mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为
您最近一年使用:0次
解题方法
5 . 为在冬奥会期间营造良好环境,京津冀地区开展秋冬季大气污染综合治理攻坚行动,取得显著成效。已知氮氧化物(NO、NO2)、SO2是大气污染物。回答下列问题:
(1)以上污染物会造成的环境问题有____ (写一种即可)。
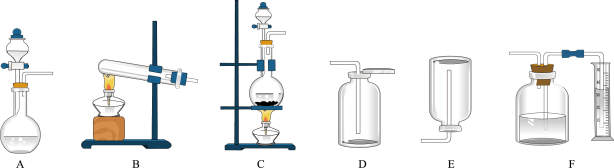
(2)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2,应选择的装置是____ (填字母)。
(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。催化反应机理如图所示,写出该反应发生的化学方程式:____ 。

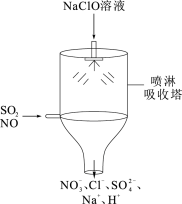
(4)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。设计该装置的优点是____ ,脱硝(NO)反应的离子方程式为____ 。
(5)某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:

①装置A中用Fe2(SO4)3溶液吸收SO2反应的离子方程式:____ 。
②反应后,若要检验SO2是否过量,可用试剂为____ 。
(1)以上污染物会造成的环境问题有
(2)如图包含气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2,应选择的装置是

(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。催化反应机理如图所示,写出该反应发生的化学方程式:

(4)目前,NaClO溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置(如图)。设计该装置的优点是

(5)某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约10%,其余为空气),实验装置如图所示:

①装置A中用Fe2(SO4)3溶液吸收SO2反应的离子方程式:
②反应后,若要检验SO2是否过量,可用试剂为
您最近一年使用:0次
解题方法
6 . 硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料,可以氨气为原料,经一系列反应制得。
NH3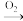 NO
NO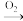 NO2
NO2 HNO3
HNO3
(1)实验室可用浓氨水和固体氧化钙制备NH3,该反应的化学方程式为_______ 。
(2)NH3与O2催化氧化反应中会得到副产物N2O,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式:_______ 。
(3)汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
①汽车燃料中一般不含氮,利用所学知识分析尾气中含有NO的原因:_______ (填化学方程式)。
②处理汽车尾气中NO和CO的一种方法:在汽车的排气管上装一个催化转化装置,使NO和CO在一定温度下均被催化转化为无毒气体。该反应的化学方程式为_______ 。
③NO、NO2都是空气污染物,等物质的量的NO和NO2的混合气体可与NaOH溶液反应生成NaNO2,反应的化学方程式为_______ 。
(4)将32.64 g Cu与140 mL一定浓度的硝酸反应,铜完全溶解,产生的混合气体(设产生的气体只有NO和NO2)在标准状况下的体积为11.2 L,待产生的气体全部释放后,向溶液中加入V mL a mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子全部转化成沉淀,原硝酸溶液的物质的量浓度为_______ (填计算式)mol·L-1。
NH3
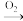 NO
NO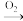 NO2
NO2 HNO3
HNO3(1)实验室可用浓氨水和固体氧化钙制备NH3,该反应的化学方程式为
(2)NH3与O2催化氧化反应中会得到副产物N2O,写出NH3与O2在加热和催化剂作用下生成N2O的化学方程式:
(3)汽车尾气已成为许多大城市空气的主要污染源。汽车尾气中含有CO、NO等多种污染物。
①汽车燃料中一般不含氮,利用所学知识分析尾气中含有NO的原因:
②处理汽车尾气中NO和CO的一种方法:在汽车的排气管上装一个催化转化装置,使NO和CO在一定温度下均被催化转化为无毒气体。该反应的化学方程式为
③NO、NO2都是空气污染物,等物质的量的NO和NO2的混合气体可与NaOH溶液反应生成NaNO2,反应的化学方程式为
(4)将32.64 g Cu与140 mL一定浓度的硝酸反应,铜完全溶解,产生的混合气体(设产生的气体只有NO和NO2)在标准状况下的体积为11.2 L,待产生的气体全部释放后,向溶液中加入V mL a mol·L-1氢氧化钠溶液,恰好使溶液中的铜离子全部转化成沉淀,原硝酸溶液的物质的量浓度为
您最近一年使用:0次
2022-04-07更新
|
753次组卷
|
2卷引用:河北省邢台市名校联盟2021-2022学年高一下学期第二次联考化学试题
7 . 在实验室,高锰酸钾因其强氧化性和溶液颜色鲜艳而用于物质的鉴定,酸性高锰酸钾溶液是氧化还原滴定的重要试剂。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒原理与下列物质相同的是___________ (填标号)。
a.“84”消毒液(NaClO溶液)
b.硫酸铜溶液
c.双氧水
d.75%的酒精
(2)高锰酸钾保存在棕色试剂瓶中,下列试剂不需要保存在棕色试剂瓶中的是___________ (填标号)。
a.浓盐酸 b.硝酸银
c.氯水 d.烧碱
(3)实验室用高锰酸钾和浓盐酸制氧气,反应的化学方程式是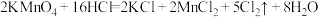 。
。
①该反应的氧化剂是___________ (填化学式),其氧化性比MnO2___________ (填“强”或“弱”)。
②若有0.4mol还原剂被氧化,则标准状况下产生Cl2的体积为___________ L。
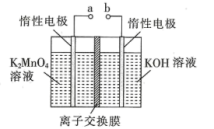
(4)高锰酸钾的制备可分两步进行:第一步,二氧化锰与氢氧化钾共熔并加入氯酸钾,得到锰酸钾;第二步,电解锰酸钾溶液。
①实验室熔融二氧化锰、氢氧化钾、氯酸钾时应选择___________ (填标号)。
A.普通玻璃坩埚 B.石英坩埚
C.陶瓷坩埚 D.铁坩埚
②第一步熔融时生成K2MnO4反应的化学方程式为___________ 。
③电解法制备KMnO4的装置如图所示,该装置发生的总反应的化学方程式为___________ 。
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒原理与下列物质相同的是
a.“84”消毒液(NaClO溶液)
b.硫酸铜溶液
c.双氧水
d.75%的酒精
(2)高锰酸钾保存在棕色试剂瓶中,下列试剂不需要保存在棕色试剂瓶中的是
a.浓盐酸 b.硝酸银
c.氯水 d.烧碱
(3)实验室用高锰酸钾和浓盐酸制氧气,反应的化学方程式是
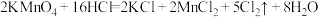 。
。①该反应的氧化剂是
②若有0.4mol还原剂被氧化,则标准状况下产生Cl2的体积为
(4)高锰酸钾的制备可分两步进行:第一步,二氧化锰与氢氧化钾共熔并加入氯酸钾,得到锰酸钾;第二步,电解锰酸钾溶液。
①实验室熔融二氧化锰、氢氧化钾、氯酸钾时应选择
A.普通玻璃坩埚 B.石英坩埚
C.陶瓷坩埚 D.铁坩埚
②第一步熔融时生成K2MnO4反应的化学方程式为
③电解法制备KMnO4的装置如图所示,该装置发生的总反应的化学方程式为

您最近一年使用:0次
名校
解题方法
8 . 双氧水(过氧化氢的水溶液)在工业生产和日常生活中应用广泛。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的_________ (填过氧化氢的化学性质)。
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为__________ 。
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为________ ,写出该反应的离子方程式________ 。
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式_______ 。

(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是_______ 。
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为__________ mol。
(1)双氧水常用于伤口消毒,这一过程利用了过氧化氢的
(2)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢。已知0.4 mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,并放出256.652kJ的热量。该反应的热化学方程式为
(3)双氧水能将碱性废水中的CN-转化成碳酸盐和一种对环境无污染的气体,CN-的电子式为
(4)下图是工业上制备过氧化氢最常见的方法,写出实际发生反应的总方程式

(5)下图是一种用电解原理来制备H2O2,并用产生的H2O2处理废氨水的装置。

①Ir-Ru惰性电极吸附O2生成H2O2,其电极反应式是
②处理废氨水中溶质(以NH3计)的质量是34g,理论上电路中转移电子数为
您最近一年使用:0次
2019-11-18更新
|
176次组卷
|
3卷引用:河北省石家庄市藁城区第一中学2020届高三上学期第三次月考化学试题



