1 . 氯气可用于制备多种消毒剂,消毒泡腾片。如“84”消毒液。漂白粉等。其中 是最新一代安全环保型高效杀菌消毒剂。含氯消毒剂可用于对生活用水受到污染的地区的饮用水或环境进行清毒。回答下列问题:
是最新一代安全环保型高效杀菌消毒剂。含氯消毒剂可用于对生活用水受到污染的地区的饮用水或环境进行清毒。回答下列问题:
(1)若将 通入紫色石蕊试液中。观察到的现象为
通入紫色石蕊试液中。观察到的现象为___________
(2) 中氯的化合价为
中氯的化合价为___________ 价。我国广泛采用经干燥空气稀释的氯气通入填有固体亚氯酸钠( )的柱内的方法制得
)的柱内的方法制得 ,发生反应的化学方程式为
,发生反应的化学方程式为___________ ,从氧化还原反应角度分析。在该反应中 的作用是
的作用是___________ ;每生成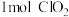 转移的电子数为
转移的电子数为___________  。
。
(3)工业上制取漂白粉的化学方程式为___________ 。若制取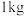 漂白粉(有效成分含量为
漂白粉(有效成分含量为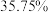 )。则至少需要标准状况下
)。则至少需要标准状况下 的体积为
的体积为___________ L。
 是最新一代安全环保型高效杀菌消毒剂。含氯消毒剂可用于对生活用水受到污染的地区的饮用水或环境进行清毒。回答下列问题:
是最新一代安全环保型高效杀菌消毒剂。含氯消毒剂可用于对生活用水受到污染的地区的饮用水或环境进行清毒。回答下列问题:(1)若将
 通入紫色石蕊试液中。观察到的现象为
通入紫色石蕊试液中。观察到的现象为(2)
 中氯的化合价为
中氯的化合价为 )的柱内的方法制得
)的柱内的方法制得 ,发生反应的化学方程式为
,发生反应的化学方程式为 的作用是
的作用是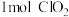 转移的电子数为
转移的电子数为 。
。(3)工业上制取漂白粉的化学方程式为
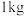 漂白粉(有效成分含量为
漂白粉(有效成分含量为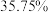 )。则至少需要标准状况下
)。则至少需要标准状况下 的体积为
的体积为
您最近一年使用:0次
解题方法
2 . 材料的发展与应用促进了人类社会的进步
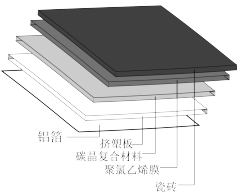
(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是_____ ;属于硅酸盐材料的是____ ;属于高分子材料的是挤塑板和______
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附 的过程中,会伴有C与
的过程中,会伴有C与 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
(3)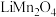 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过 与
与 煅烧制备,同时还生成
煅烧制备,同时还生成 和一种单质,写出该反应的化学方程式:
和一种单质,写出该反应的化学方程式:________
(4)某原电池装置如图所示:
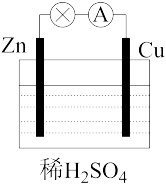
①负极的电极反应式是_______ ;
②当铜表面析出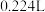 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了____  电子
电子

(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附
 的过程中,会伴有C与
的过程中,会伴有C与 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:(3)
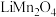 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过 与
与 煅烧制备,同时还生成
煅烧制备,同时还生成 和一种单质,写出该反应的化学方程式:
和一种单质,写出该反应的化学方程式:(4)某原电池装置如图所示:

①负极的电极反应式是
②当铜表面析出
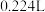 氢气(标准状况)时,导线中通过了
氢气(标准状况)时,导线中通过了 电子
电子
您最近一年使用:0次
名校
解题方法
3 . 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
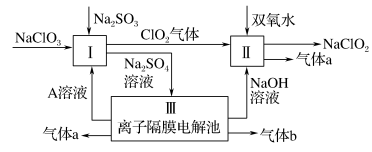
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____ 。
(3)Ⅲ中离子隔膜电解池的装置如下:
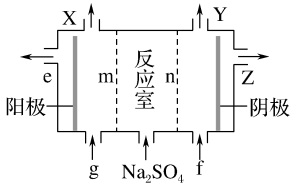
①A的化学式是________ ,A在____ 口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____ 。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____ 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。

(1)Ⅰ中发生反应的还原剂是
(2)Ⅱ中反应的离子方程式是
(3)Ⅲ中离子隔膜电解池的装置如下:

①A的化学式是
②m为
③结合化学用语和文字说明解释NaOH产生的原因:
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者
您最近一年使用:0次



