名校
1 . 铜及其化合物应用广泛。回答下列问题:
(1)目前铜可采用如下方法制备:
方法1:火法炼铜: ;
;
方法2:湿法炼铜: 。
。
上述两种方法中,方法2比方法1更好,其原因是_______ (写出一条原因即可)。上述两种方法冶炼铜中,若转移的电子数相同,则方法1和方法2冶炼出的铜的质量之比为_______ 。
(2)黄铜矿的含铜成分为 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为_______ 。
(3)将 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为_______ g。
(4) 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知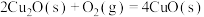
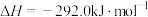 ;则
;则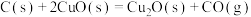 的
的
_______  。
。
(5)某同学利用下图装置进行铁上电镀铜的实验探究。
①实验ⅰ中气体减少的原因是_______ 。
②实验ⅰ中,推测产生 ,可能发生的反应有
,可能发生的反应有 、
、_______ 。
③随着阴极析出 ,实验ⅱ中
,实验ⅱ中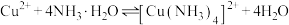 平衡不移动,理由是
平衡不移动,理由是_______ 。
(1)目前铜可采用如下方法制备:
方法1:火法炼铜:
 ;
;方法2:湿法炼铜:
 。
。上述两种方法中,方法2比方法1更好,其原因是
(2)黄铜矿的含铜成分为
 ,常采用
,常采用 溶液浸取,生成
溶液浸取,生成 和
和 等,该反应的化学方程式为
等,该反应的化学方程式为(3)将
 、
、 和
和 组成的混合物加入
组成的混合物加入 溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况)
溶液恰好使混合物完全溶解,同时收集到2.24L(标准状况) 气体。若将此混合物用足量的
气体。若将此混合物用足量的 加热还原,所得固体的质量为
加热还原,所得固体的质量为(4)
 和
和 的燃烧热分别为
的燃烧热分别为 、
、 ,已知
,已知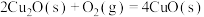
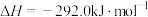 ;则
;则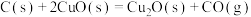 的
的
 。
。(5)某同学利用下图装置进行铁上电镀铜的实验探究。
| 实验序号 | 装置示意图 | 实验现象 |
| 1 | 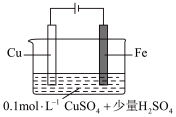 | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 |
| 2 | 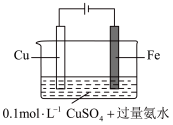 | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 元素 元素 |
②实验ⅰ中,推测产生
 ,可能发生的反应有
,可能发生的反应有 、
、③随着阴极析出
 ,实验ⅱ中
,实验ⅱ中 平衡不移动,理由是
平衡不移动,理由是
您最近一年使用:0次
2024-01-01更新
|
214次组卷
|
2卷引用:湖北省九师联盟2024届高三11月质检化学试题
名校
2 . 镍铼高温合金可用于制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴。NH4ReO4是制备高纯度Re的原料。实验室制备NH4ReO4的装置如图所示。
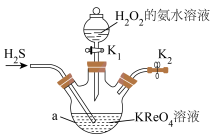
已知: Ⅰ.KReO4、与H2S反应生成Re2Sn7;
Ⅱ.2NH4ReO4+7H2=2Re+ 2NH3 + 8H2O。
有关物质的溶解度S见下表:
回答下列问题:
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这--现象的理论是_______________ 。
(2)仪器a的名称是__________ 。
(3)反应开始前先向仪器a中加入一定量的KReO4溶液,再通入一定量的H2S,反应一段时间,仪器a内生成Re2S7,然后滴入足量的H2O2的氨水溶液,生成NH4ReO4,同时有硫酸铵生成;写出生成NH4ReO4的化学方程式:_____ ,反应结束后从溶液中分离出NH4ReO4的方法是_______ 。
(4)氢气还原NH4ReO4制备金属铼时,在加热前,需先通入一段时间的氢气,其目的是_____ 。实验室制取氢气时,常用粗锌粒而不用纯锌,其原因是___ 。

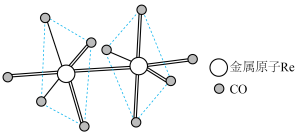
(5)铼可形成多种配位化合物, Re2 (CO)10就是其中的一种,其结构如图,其中配位原子为_______ (填“C"或“O")。

已知: Ⅰ.KReO4、与H2S反应生成Re2Sn7;
Ⅱ.2NH4ReO4+7H2=2Re+ 2NH3 + 8H2O。
有关物质的溶解度S见下表:
| 温度/℃ | S[(NH4)2SO4]/g | S[NH4ReO4]/g |
| 20 | 75.4 | 6.1 |
| 30 | 78.0 | 32.3 |
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这--现象的理论是
(2)仪器a的名称是
(3)反应开始前先向仪器a中加入一定量的KReO4溶液,再通入一定量的H2S,反应一段时间,仪器a内生成Re2S7,然后滴入足量的H2O2的氨水溶液,生成NH4ReO4,同时有硫酸铵生成;写出生成NH4ReO4的化学方程式:
(4)氢气还原NH4ReO4制备金属铼时,在加热前,需先通入一段时间的氢气,其目的是

(5)铼可形成多种配位化合物, Re2 (CO)10就是其中的一种,其结构如图,其中配位原子为

您最近一年使用:0次
2023-08-20更新
|
158次组卷
|
2卷引用:湖北省部分学校2024届高三上学期8月起点考试化学试题
名校
解题方法
3 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
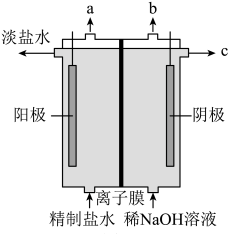
(1)氯气是制备系列含氯化合物的主要原料,请写出化学家舍勒发现氯气的化学方程式:_______ 。也可采用如图所示的装置来制取氯气,装置中氯气的逸出口是_______ (填标号)。
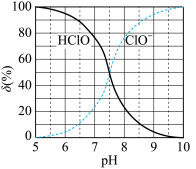
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ,δ(X)=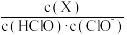 ,X为HClO或ClO−]与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图所示。HClO的电离常数Ka值为____ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为_______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_______ mol;产生“气泡”的化学方程式为_______ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为_______ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,请写出化学家舍勒发现氯气的化学方程式:

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ,δ(X)=
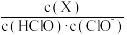 ,X为HClO或ClO−]与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图所示。HClO的电离常数Ka值为
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
4 . 70年代开始发现氯气应用水消毒会产生具有致癌作用的卤代甲烷类化合物。氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广泛消毒剂,是一种黄绿色的气体,易溶于水。我国从2000年起已逐步用消毒剂ClO2代替氯气对饮用水进行消毒。
(1)ClO2消毒水时,可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO-2含量应不超过0.2mg/L。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是_____________ (填化学式)。
ClO2在杀菌消毒的同时,可将剧毒氰化物中碳、氮元素氧化成无毒气体而除去,写出用ClO2氧化除去NaCN的化学方程式___________________________________ 。
(2)①工业上制备ClO2,可以通过NaClO3在H2SO4存在的条件下与Na2SO3反应制得。
请写出该反应的离子方程式:_________________________________________ 。
②实验室制备ClO2,可以用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料在一定条件下制得,只是制得的ClO2中混有NH3除去ClO2中的NH3可选用的试剂是____ ;(填序号)
A.浓硫酸 B.饱和食盐水
C.碱石灰 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-===2I—+S4O62—),共用去V ml硫代硫酸钠溶液。

①装置中玻璃液封管的作用是__________________ ;
②滴定终点的现象是:_________________________ 。
(1)ClO2消毒水时,可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-。2001年我国卫生部规定,饮用水的ClO-2含量应不超过0.2mg/L。若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是
ClO2在杀菌消毒的同时,可将剧毒氰化物中碳、氮元素氧化成无毒气体而除去,写出用ClO2氧化除去NaCN的化学方程式
(2)①工业上制备ClO2,可以通过NaClO3在H2SO4存在的条件下与Na2SO3反应制得。
请写出该反应的离子方程式:
②实验室制备ClO2,可以用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料在一定条件下制得,只是制得的ClO2中混有NH3除去ClO2中的NH3可选用的试剂是
A.浓硫酸 B.饱和食盐水
C.碱石灰 D.水
(3)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-===2I—+S4O62—),共用去V ml硫代硫酸钠溶液。

①装置中玻璃液封管的作用是
②滴定终点的现象是:
您最近一年使用:0次



