名校
解题方法
1 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
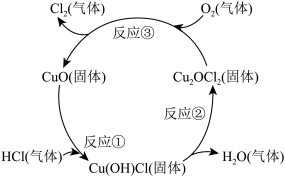
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
395次组卷
|
3卷引用:四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题
名校
解题方法
2 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是_______ nm。
(2)在实验室中,FeCl3可以用铁粉与_______ 反应制备,保存FeCl2溶液会加入少量铁屑,其原理是_______ (用化学方程式表示)。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:_______ 。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①甲同学取少量待测溶液﹐滴入_______ (写出试剂名称),溶液呈红色,证明溶液中含有Fe3+。
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是_______ 。(用离子方程式和必要的文字进行解释)已知:氧化性KMnO4>Cl2
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为_______ 。
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
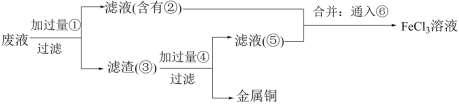
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:_______ 。用H2O2代替⑥也能实现实验目的。请写出加入H2O2的离子方程式:_______ 。
(1)向沸水中逐滴滴加lmol/LFeCl3溶液﹐至液体呈透明的红褐色,该分散系中粒子直径的范围是
(2)在实验室中,FeCl3可以用铁粉与
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
①甲同学取少量待测溶液﹐滴入
②乙同学取少量待测溶液﹐滴加酸性高锰酸钾溶液,振荡后紫红色褪去,因此他得出结论,溶液中存在Fe2+。丙同学认为乙同学的实验方法不严谨,理由是
③通过查阅资料,同学们得知,Fe2+能与K3[Fe(CN)6)]溶液反应生成Fe3[Fe(CN)6)]2蓝色沉淀。乙同学另取少量待测溶液﹐滴加K3[Fe(CN)6)]溶液,有蓝色沉淀生成,证明溶液中存在Fe2+。该反应的离子方程式为
(4)欲从FeCl3腐蚀铜后所得溶液中回收铜,并重新获得FeCl3溶液,设计实验方案如下:
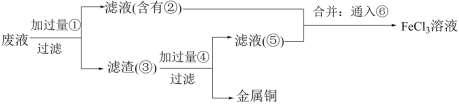
已知⑥为黄绿色的气体单质,请写出通入⑥的离子方程式:
您最近一年使用:0次
2022-04-05更新
|
406次组卷
|
2卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
名校
3 . 根据所学知识,回答下列问题:
(1)下表是对一些物质进行分类
其中 Na2O2中O____ 价,它____ 碱性氧化物(填“是”或“不是”)
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:___________ ,写出过氧化钠与水反应的离子方程式:___________ 。
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:__________ 。氯气通入到⑥的溶液中的离子方程式:___________ 。
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:___________ 。
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是_____ 。(填写字母)
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:___________ 。
(1)下表是对一些物质进行分类
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 单质 |
| 化学式 | ①H2SO4 ②HCl | ③NaOH ④Ba(OH)2 | ⑤NaHCO3 ⑥NaI | ⑦CO2 ⑧Na2O2 | ⑨O2 ⑩Cl2 |
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:
您最近一年使用:0次
名校
4 . 铁元素在地壳中含量居于第四位。铁是目前产量最大,使用最广泛的金属。我国目前发现最早的人工冶铁制品是河南三门峡出土的西周晚期的玉柄铁剑。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释___________ 。
(2)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板,请用离子方程式解释该现象:___________ 。
(3)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下:_______ClO- ___________
___________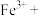 ___________=___________
___________=___________ ___________
___________ ___________
___________ ,请将方程式补充完整并配平该方程式
,请将方程式补充完整并配平该方程式__________ 。
(4) 很不稳定,露置在空气中容易被氧化,该反应的化学方程式为
很不稳定,露置在空气中容易被氧化,该反应的化学方程式为___________ ,现象为___________ 。
(5)向一个金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,请用离子方程式解释罐子重新鼓起的现象:___________ 。
(1)在钢铁厂的生产中,炽热的铁水或钢水注入模具之前必须进行充分的干燥处理,不得留有水,请用化学方程式解释
(2)电子工业中常用FeCl3溶液作为“腐蚀液”腐蚀覆铜板,请用离子方程式解释该现象:
(3)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下:_______ClO-
 ___________
___________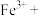 ___________=___________
___________=___________ ___________
___________ ___________
___________ ,请将方程式补充完整并配平该方程式
,请将方程式补充完整并配平该方程式(4)
 很不稳定,露置在空气中容易被氧化,该反应的化学方程式为
很不稳定,露置在空气中容易被氧化,该反应的化学方程式为(5)向一个金属铝的易拉罐内充满CO2,然后向罐内注入足量NaOH溶液,立即用胶布严封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起,请用离子方程式解释罐子重新鼓起的现象:
您最近一年使用:0次
名校
解题方法
5 . 化学是一门以实验为基础的学科,研究小组需要经常做实验。
Ⅰ.某研究小组甲模仿侯德榜制备纯碱,原理为向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳。
(1)析出溶解度______ (填较小或较大)的碳酸氢钠,该反应离子方程式为______ 。
(2)欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是______(选装置)。
Ⅱ.某研究小组乙在探究 的性质实验时,发现
的性质实验时,发现 样品与过量水反应,待完全反应不再产生氧气后,得溶液
样品与过量水反应,待完全反应不再产生氧气后,得溶液 。溶液
。溶液 可使酸性
可使酸性 溶液褪色,同时放出氧气。小组成员查阅资料表明,
溶液褪色,同时放出氧气。小组成员查阅资料表明, 与水反应还可生成H2O2。
与水反应还可生成H2O2。
(3) 与水反应生成
与水反应生成 的反应是否属于氧化还原反应
的反应是否属于氧化还原反应______ (填是、否)。
(4)写出 与水反应的离子反应方程式:
与水反应的离子反应方程式:______ 。
(5)完成并配平该反应的离子方程式:__________ 。
 +H2O2+H+→Mn2++O2↑+□____
+H2O2+H+→Mn2++O2↑+□____
Ⅰ.某研究小组甲模仿侯德榜制备纯碱,原理为向饱和食盐水中通入足量氨气至饱和,然后通入过量二氧化碳。
(1)析出溶解度
(2)欲得到纯碱,该研究小组将固体过滤、洗涤后,还需进行的操作是______(选装置)。
A. | B.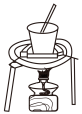 |
C. | D. |
Ⅱ.某研究小组乙在探究
 的性质实验时,发现
的性质实验时,发现 样品与过量水反应,待完全反应不再产生氧气后,得溶液
样品与过量水反应,待完全反应不再产生氧气后,得溶液 。溶液
。溶液 可使酸性
可使酸性 溶液褪色,同时放出氧气。小组成员查阅资料表明,
溶液褪色,同时放出氧气。小组成员查阅资料表明, 与水反应还可生成H2O2。
与水反应还可生成H2O2。(3)
 与水反应生成
与水反应生成 的反应是否属于氧化还原反应
的反应是否属于氧化还原反应(4)写出
 与水反应的离子反应方程式:
与水反应的离子反应方程式:(5)完成并配平该反应的离子方程式:
 +H2O2+H+→Mn2++O2↑+□____
+H2O2+H+→Mn2++O2↑+□____
您最近一年使用:0次
解题方法
6 . 自然界中含硫物质不断发生转化和转移,形成了硫元素的循环。利用这些转化可以制备重要的化工产品,过程中产生的 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。
(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。 的结构式为
的结构式为___________ 。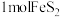 与
与 和
和 溶液反应转化为
溶液反应转化为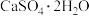 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为___________  。
。
(2)工业上利用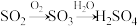 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。___________ (写出两点)。
②装置Ⅲ用于吸收 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是___________ (填字母)。
A. 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸
③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是___________ 。若用 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将___________ (填“增大”“减小”或“不变”)。
(3) 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。___________ 。
(4) 的“再生”是在
的“再生”是在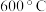 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是___________ 。
 等会污染环境,需要加以治理。
等会污染环境,需要加以治理。(1)火山喷发是硫元素在自然界中转化的一种途径,反应过程如图所示。
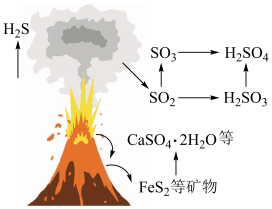
 的结构式为
的结构式为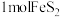 与
与 和
和 溶液反应转化为
溶液反应转化为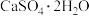 和
和 ,理论上转移电子的物质的量为
,理论上转移电子的物质的量为 。
。(2)工业上利用
 的转化制备硫酸,其模拟实验的部分装置如图所示。
的转化制备硫酸,其模拟实验的部分装置如图所示。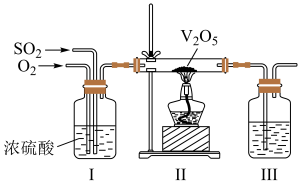
②装置Ⅲ用于吸收
 制备硫酸,适宜的吸收剂是
制备硫酸,适宜的吸收剂是A.
 溶液 B.水 C.
溶液 B.水 C. 浓硫酸
浓硫酸③装置Ⅱ中待反应进行后撤走酒精灯,无需持续加热,原因是
 、水在催化剂存在时吸收尾气中的
、水在催化剂存在时吸收尾气中的 ,吸收完成后,随着氧化的进行,溶液的
,吸收完成后,随着氧化的进行,溶液的 将
将(3)
 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的反应机理如图所示。
再生的反应机理如图所示。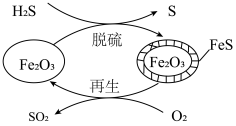
(4)
 的“再生”是在
的“再生”是在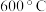 时,用一定浓度的
时,用一定浓度的 与
与 反应实现(如上图所示)。温度略低于
反应实现(如上图所示)。温度略低于 时,“再生”所得固体质量增加,原因是
时,“再生”所得固体质量增加,原因是
您最近一年使用:0次
2024-02-04更新
|
566次组卷
|
2卷引用:四川省达州外国语学校2023-2024学年高一下学期3月月考化学试题
名校
解题方法
7 . 氮是生命体重要的组成元素,自然界中氮的循环对生命活动有重要意义。
(1)汽车尾气主要含有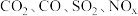 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的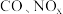 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为___________ 。
(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。___________ ;丙为钠盐,其化学式为__________ 。
②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为________ 。实验室用该反应原理制取并收集一瓶干燥的甲气体,从下图中选择合适的装置,其连接顺序为___________ 。(按从左到右的气流方向,用小写字母 和箭头表示)___________ (填字母)。
A. B.
B. C.
C. D.
D.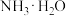
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与 按物质的量
按物质的量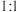 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式___________ 。
(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。___________ 种价态。反应③和⑤中,若生成等物质的量的 ,则转移的电子数之比为
,则转移的电子数之比为___________ 。
(1)汽车尾气主要含有
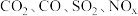 等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的
等物质,这种尾气逐渐成为城市空气污染的主要来源之一、其中的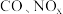 ,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为
,在适宜条件下会转化为参与大气循环的两种无毒气体,该过程的化学反应方程式为(2)“价-类”二维图是学习元素化合物性质的重要方法,利用所学知识能更好地了解氮的循环。

②甲为常见的碱性气体,是制造氮肥、炸药等物质的化工原料。实验室制备甲的化学方程式为

A.
 B.
B. C.
C. D.
D.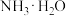
④丁主要用于染料、医药、印染、漂白等方面,且丁的焰色反应呈黄色。丁在酸性条件下,与
 按物质的量
按物质的量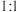 恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式
恰好完全反应,生成能使淀粉变蓝的物质,写出该过程发生的离子反应方程式(3)海洋生物参与氮循环的过程如图所示(其它含氨物质不参与反应)。
 ,则转移的电子数之比为
,则转移的电子数之比为
您最近一年使用:0次
2024-02-21更新
|
724次组卷
|
2卷引用:四川省达州外国语学校2023-2024学年高一下学期3月月考化学试题
名校
8 . 合成氨工业对人类社会的发展具有里程碑式意义。
(1)工业常用CH4与H2O高温下制合成氨的原料气H2,1molCH4完全转化为CO2时理论能制得H2的物质的量为___________ 。
(2)等离子体合成氨使用H2O代替H2作为氢源,模拟制备原理如图所示,在高压电场作用下,N2与H2O以一定流速通过反应器,主要得到NH3与HNO2(弱酸),气体流出反应器后,经过一定长度的导管进入成分分析装置。

①等离子体合成氨反应的化学方程式为___________ 。
②成分分析表明,连接反应器与成分分析装置的导管的长度d越长,测得气体中NH3与HNO2的含量越低,其原因可能是___________ 。
③若将原料气中N2替换为空气,反应器流出气体中NH3及NOx浓度随原料气相对湿度(水蒸气含量)的变化如图所示,流出气体中NH3的浓度几乎为0的原因可能是___________ 。

(1)工业常用CH4与H2O高温下制合成氨的原料气H2,1molCH4完全转化为CO2时理论能制得H2的物质的量为
(2)等离子体合成氨使用H2O代替H2作为氢源,模拟制备原理如图所示,在高压电场作用下,N2与H2O以一定流速通过反应器,主要得到NH3与HNO2(弱酸),气体流出反应器后,经过一定长度的导管进入成分分析装置。

①等离子体合成氨反应的化学方程式为
②成分分析表明,连接反应器与成分分析装置的导管的长度d越长,测得气体中NH3与HNO2的含量越低,其原因可能是
③若将原料气中N2替换为空气,反应器流出气体中NH3及NOx浓度随原料气相对湿度(水蒸气含量)的变化如图所示,流出气体中NH3的浓度几乎为0的原因可能是

您最近一年使用:0次
2023-06-28更新
|
200次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高二上学期开学考试化学试题
名校
9 . 电催化还原 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
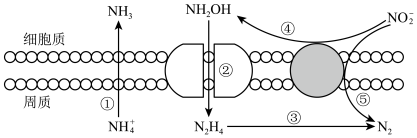
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
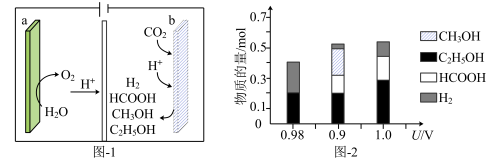
①电解前需向电解质溶液中持续通入过量 的原因是
的原因是___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用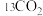 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是___________ 。
(2)一种铜基复合电极材料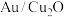 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加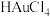 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得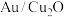 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原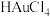 的离子方程式:
的离子方程式:___________ 。
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。
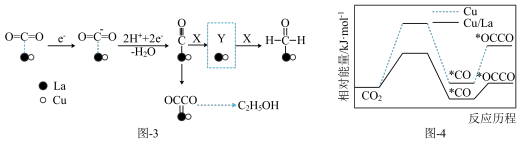
①X为___________ 。在答题卡上相应位置补充完整虚线框内Y的结构。_________
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原 的优点是
的优点是___________ 。
 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原
 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
①电解前需向电解质溶液中持续通入过量
 的原因是
的原因是②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用
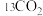 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是(2)一种铜基复合电极材料
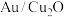 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加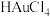 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得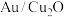 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原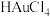 的离子方程式:
的离子方程式:(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。

①X为
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原
 的优点是
的优点是
您最近一年使用:0次
2023-05-27更新
|
741次组卷
|
6卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题
四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题江苏省南通市2023届高三下学期第四次模拟考试化学试题江苏省盐城市伍佑中学2023届高三下学期模拟预测化学试题(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第25讲电解池与金属的电化学腐蚀江苏省南京师范大学苏州实验学校2023-2024学年高三上学期零模考试热身练化学试题
名校
解题方法
10 . 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________ (填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________ 。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________ (填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O +2I-=2SO
+2I-=2SO +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________ 、________ (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________ .
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________ .证明炉渣中含有FeO的实验现象为____________________________________ 。
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O
 +2I-=2SO
+2I-=2SO +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为
您最近一年使用:0次



