1 . 为探究甲醛与新制Cu(OH)2反应的产物,设计了如下实验。回答下列问题:
I.反应装置如下:
(1)仪器a的名称是___________ ,该反应需控制温度为65℃,宜采用的加热方式为___________ (填标号)。
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
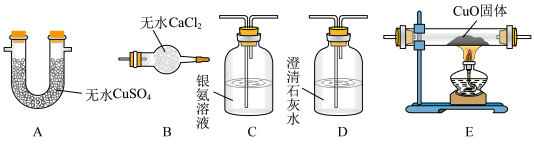
(2)为确定气体成分,下列实验装置的连接顺序是___________ ( 按气流方向填大写字母,个别装置可重复使用)。(已知:CO与银氨溶液能发生氧化还原反应)___________ 。
(3)为确定溶液中产物与固体产物,小组做了以下实验: (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。
①由实验现象可知,液体产物中存在离子是___________ (填离子符号)。
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为___________ 。
③滤液2在空气中放置一段时间后,显蓝色的离子是___________ (填离子符号)。
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是___________ 。
I.反应装置如下:
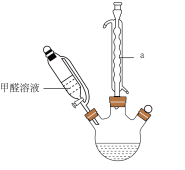
(1)仪器a的名称是
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
| 气体产物 | H2、CO、CO2 |
| 溶液中产物 | HCOO-、 |
| 固体产物 | Cu、Cu2O |
(3)为确定溶液中产物与固体产物,小组做了以下实验:
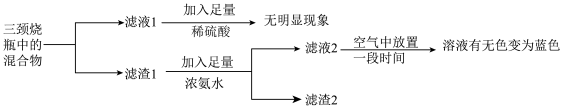
 (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。①由实验现象可知,液体产物中存在离子是
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为
③滤液2在空气中放置一段时间后,显蓝色的离子是
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是
您最近一年使用:0次
2023-06-19更新
|
100次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2023-2024学年高三上学期期中考试理综试题
名校
2 . 高铁酸钾( ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
实验(一)制备
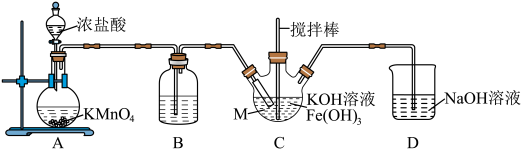
(1)仪器M的名称是_______ ,装置B的作用是_______ 。
(2)装置C中生成 的化学方程式为
的化学方程式为______ 。
(3)实验得知装置C中吸收 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为_______ g。
实验(二)探究 的性质。
的性质。
Ⅰ.探究 在酸性条件下的稳定性。
在酸性条件下的稳定性。
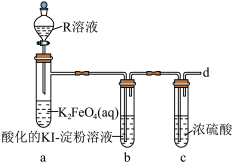
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为_______ (填“稀硫酸”或“盐酸”),写出装置a中的离子方程式:______ ,不选择另一种酸的主要原因是_______ 。
(5)设计一种方案检验从d中逸出的气体:_______
Ⅱ.探究在酸性条件下的氧化性。
(6)向 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。_______ (填“能”或“不能”)证明氧化性: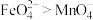 ,原因是
,原因是_______ (用文字说明)。
 ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:实验(一)制备


(1)仪器M的名称是
(2)装置C中生成
 的化学方程式为
的化学方程式为(3)实验得知装置C中吸收
 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为实验(二)探究
 的性质。
的性质。Ⅰ.探究
 在酸性条件下的稳定性。
在酸性条件下的稳定性。
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为
(5)设计一种方案检验从d中逸出的气体:
Ⅱ.探究在酸性条件下的氧化性。
(6)向
 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。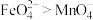 ,原因是
,原因是
您最近一年使用:0次
2023-09-27更新
|
353次组卷
|
11卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷河北省邢台市五岳联盟2023-2024学年高三上学期9月月考化学试题河北省部分学校2023-2024学年高三上学期9月月考化学试题河南省2023-2024学年高三上学期一轮复习阶段性检测(三)化学试题河南省驻马店市第一次联考2023-2024学年高三上学期9月月考化学试题江西省部分高中学校2024届高三上学期9月大联考化学试题福建省2023-2024学年高三上学期10月百万大联考化学试题 河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期阶段性考试(三)化学试题河北省保定部分高中2023-2024学年高三上学期9月月考化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省濮阳市油田第一中学2024届高三上学期第一次考试理科综合化学试题
3 . 铁是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工业上常用 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:

①试剂D为___________ (填名称)。
②滤液B的溶质为___________ (填化学式)。
③通入气体F时发生反应的离子方程式为___________ 。
④实验中若要证明蚀刻废液中不含 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为___________ 。
(2)水热法制备 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:
①水热法制备 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为___________ (填元素符号)。
②该反应的化学方程式中
___________ 。
③每生成 ,反应转移的电子为
,反应转移的电子为___________  。
。
(1)工业上常用
 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:
①试剂D为
②滤液B的溶质为
③通入气体F时发生反应的离子方程式为
④实验中若要证明蚀刻废液中不含
 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为(2)水热法制备
 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:①水热法制备
 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为②该反应的化学方程式中

③每生成
 ,反应转移的电子为
,反应转移的电子为 。
。
您最近一年使用:0次
2021-01-30更新
|
460次组卷
|
5卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题
名校
解题方法
4 . 常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
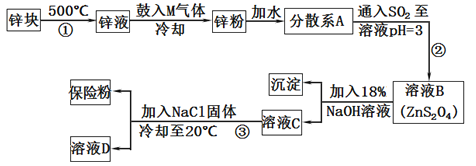
请回答下列问题:
(1)保险粉应如何保存?_______________________ (填一个注意事项)。
(2)由锌块制备锌粉的目的是___________ ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为___________ ;分散系A为____________ (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为_____________________ 。
(4)流程③的分离方法步骤为___________ 、洗涤、干燥,其中洗涤所用试剂是__________ ;实验室加入NaCl固体的作用是_____________ 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式____________________ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②__________________ 。

请回答下列问题:
(1)保险粉应如何保存?
(2)由锌块制备锌粉的目的是
(3)流程②的化学方程式为
(4)流程③的分离方法步骤为
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②
您最近一年使用:0次
2017-02-17更新
|
1264次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题
5 . 氯化铬晶体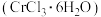 是一种重要的工业原料,工业上常用铬酸钠
是一种重要的工业原料,工业上常用铬酸钠 来制备。实验室中以红矾钠
来制备。实验室中以红矾钠 为原料制备
为原料制备 的流程如下:
的流程如下:

已知:① ;
;
② 不溶于乙醚,易溶于水、乙醇,易水解;
不溶于乙醚,易溶于水、乙醇,易水解;
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是________________ 。
(2)还原时先加入过量 再加入10%HCl,生成
再加入10%HCl,生成 ,该反应的离子方程式为
,该反应的离子方程式为________________ 。
(3)用蒸馏法从滤液中分离出 循环使用。
循环使用。
①下列有关蒸馏实验说法正确的是_________ (填序号)。
A.蒸馏开始,应先加热再通冷凝水
B.通过蒸馏可除去液体中难挥发或不挥发的杂质
C.若温度计插入混合液中,则会收集到沸点偏高的杂质
D.当蒸馏沸点过高的成分时,应用空气冷凝
②实验设计用下图装置进行蒸馏,该装置中存在的错误有_________ 。

③在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的 。有的同学认为,该过程中需要加入CaO,防止水随
。有的同学认为,该过程中需要加入CaO,防止水随 一起蒸出,你认为是否有必要并说明理由:
一起蒸出,你认为是否有必要并说明理由:_______ 。
(4)请补充完整由过滤后得到的固体 制备
制备 的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体
的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体__________ ,__________ ,冷却结晶,过滤,__________ ,低温干燥,得到 。
。
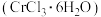 是一种重要的工业原料,工业上常用铬酸钠
是一种重要的工业原料,工业上常用铬酸钠 来制备。实验室中以红矾钠
来制备。实验室中以红矾钠 为原料制备
为原料制备 的流程如下:
的流程如下:
已知:①
 ;
;②
 不溶于乙醚,易溶于水、乙醇,易水解;
不溶于乙醚,易溶于水、乙醇,易水解;③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是
(2)还原时先加入过量
 再加入10%HCl,生成
再加入10%HCl,生成 ,该反应的离子方程式为
,该反应的离子方程式为(3)用蒸馏法从滤液中分离出
 循环使用。
循环使用。①下列有关蒸馏实验说法正确的是
A.蒸馏开始,应先加热再通冷凝水
B.通过蒸馏可除去液体中难挥发或不挥发的杂质
C.若温度计插入混合液中,则会收集到沸点偏高的杂质
D.当蒸馏沸点过高的成分时,应用空气冷凝
②实验设计用下图装置进行蒸馏,该装置中存在的错误有

③在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的
 。有的同学认为,该过程中需要加入CaO,防止水随
。有的同学认为,该过程中需要加入CaO,防止水随 一起蒸出,你认为是否有必要并说明理由:
一起蒸出,你认为是否有必要并说明理由:(4)请补充完整由过滤后得到的固体
 制备
制备 的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体
的实验方案(可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚):将过滤后所得固体 。
。
您最近一年使用:0次
2020-02-28更新
|
161次组卷
|
3卷引用:青海省青海师范大学附属实验中学2022-2023学年高一上学期12月月考化学试题



