1 . 在碘水、淀粉、稀 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: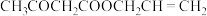
AAAI为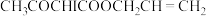
下列说法不正确 的是
 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: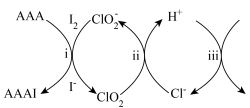
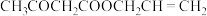
AAAI为
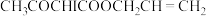
下列说法
| A.i为取代反应 | B.ii的反应为 |
C.iii中,生成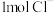 转移 转移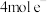 | D.最终溶液呈蓝色 |
您最近一年使用:0次
2 . 下列解释事实的离子方程式不正确的是
A.氧化钙溶于稀硝酸: |
B.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解: |
C.硫酸铜溶液中加少量的铁粉,溶液蓝色变浅: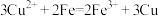 |
D.向酸性的淀粉—碘化钾溶液中滴加适量双氧水,溶液变蓝: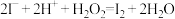 |
您最近一年使用:0次
解题方法
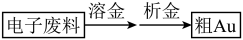
3 . 从电子废料(含Au、Ag和Cu等)中可回收金,主要流程如下: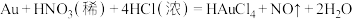
下列说法不正确 的是
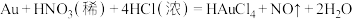
下列说法
A.浓盐酸促进了Au和 的反应,其原因是降低了 的反应,其原因是降低了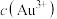 ,增强了Au的还原性 ,增强了Au的还原性 |
B.依据王水溶金原理,NaCN饱和溶液与 也可使Au溶解 也可使Au溶解 |
C. 可实现析金发生反应: 可实现析金发生反应: |
D.以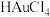 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 为电解质进行粗金的电解精炼,可能会有AgCl覆盖在阴极发生钝化 |
您最近一年使用:0次
名校
解题方法
4 . 研究人员提出利用热化学硫碘循环实现硫化氢分解联产氢气和硫黄,转化过程如下,其中Y、Z代表I2或HI中的一种。下列说法不正确 的是
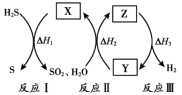
| A.Y在Z溶液中比在H2SO4溶液中易溶 |
| B.反应I中X的浓度与硫黄的产率无关 |
| C.反应Ⅱ的化学方程式为SO2+2H2O+I2=H2SO4+2HI |
| D.等压条件下,反应Ⅰ、Ⅱ、Ⅲ的反应热之和等于硫化氢直接分解的反应热 |
您最近一年使用:0次
2024-04-15更新
|
241次组卷
|
2卷引用:北京市朝阳区2023-2024学年高三下学期一模化学试题
5 . 工业上利用“碘循环”吸收 ,同时制得
,同时制得 ,流程如图所示。下列说法正确的是
,流程如图所示。下列说法正确的是
 ,同时制得
,同时制得 ,流程如图所示。下列说法正确的是
,流程如图所示。下列说法正确的是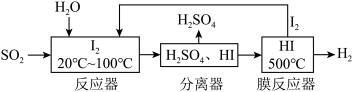
A.反应器中发生的反应离子方程式为: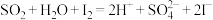 |
B.反应器中控制温度的目的是增大 的溶解度以加快吸收 的溶解度以加快吸收 |
| C.分离器中物质分离的方法为蒸馏 |
| D.膜反应器中,增大压强有利于提高平衡转化率 |
您最近一年使用:0次
6 . 下列方程式与所给事实相符的是
A.常温下,0.1mol·L-1 H3PO4溶液pH约为3.1:H3PO4=3H++PO |
B.还原铁粉与水蒸气反应有可燃性气体产生:3Fe+4H2O(g) Fe3O4+4H2 Fe3O4+4H2 |
| C.向H218O中加入Na2O2,产生无色气体:2H218O+2Na2O2=4Na++4OH-+18O2↑ |
D.向NH4HSO4溶液中滴加过量NaOH溶液,产生无色气体:NH +OH-=NH3↑+H2O +OH-=NH3↑+H2O |
您最近一年使用:0次
2024·北京·模拟预测
名校
解题方法
7 . 分析含有少量NaOH的NaClO溶液与FeSO4溶液的反应。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
已知:①图1表示将FeSO4溶液逐滴滴加到含少量NaOH的NaClO溶液中的pH变化;②图2表示NaClO溶液中含氯微粒的物质的量分数与pH的关系[注:饱和NaClO溶液的pH约为11; Ksp[Fe(OH)3]=2.8×10−39]。
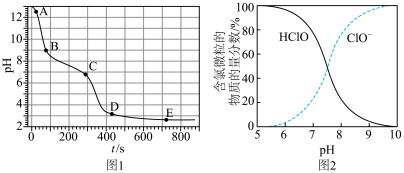
A.A点溶液的pH约为13,主要原因是ClO− + H2O HClO + OH− HClO + OH− |
| B.AB段pH显著下降的原因是5ClO-+2Fe2+ + 5H2O=Cl−+ 2Fe(OH)3↓+ 4HClO |
| C.CD段较BC段pH下降快的主要原因是HClO+2Fe2+ +5H2O=2Fe(OH)3↓+Cl-+ 5H+ |
| D.反应进行至400s时溶液中产生Cl2的原因是:ClO-+ Cl-+2H+=Cl2↑+ H2O |
您最近一年使用:0次
2024-03-19更新
|
484次组卷
|
5卷引用:2023-2024学年度第二学期高三化学零模试卷
(已下线)2023-2024学年度第二学期高三化学零模试卷北京市师范大学附属实验中学2024届高三零模化学试题北京市顺义牛栏山第一中学2023-2024学年高二下学期4月月考化学试题2024届河南省信阳高级中学高三下学期模拟考试(十六)理科综合试题-高中化学(已下线)压轴题01?离子方程式与离子共存的判断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
2024·北京·模拟预测
名校
解题方法
8 . 下列有关离子方程式书写正确的是
A.用酸性KMnO4标准液滴定草酸:16H++5 +2 +2 = 2Mn2++8H2O+10CO2 ↑ = 2Mn2++8H2O+10CO2 ↑ |
B.用NaClO溶液吸收少量SO2: 2ClO- +SO2+H2O=2HClO+ |
C.向NH4HCO3溶液中加入含Mn2+的溶液生成MnCO3:Mn2++ =MnCO3↓+ H+ =MnCO3↓+ H+ |
D.用稀硝酸洗涤试管内壁的银镜: 3Ag+4H++ = 3Ag++NO↑+2H2O = 3Ag++NO↑+2H2O |
您最近一年使用:0次
名校
解题方法
9 . 煤燃烧排放的烟气中含有 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气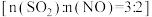 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
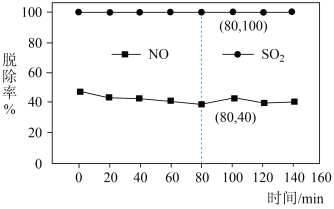
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气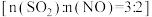 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
A.脱除 的反应: 的反应: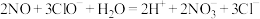 |
B.依据图中信息,在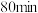 时,吸收液中 时,吸收液中 |
C. 脱除率高于 脱除率高于 的原因可能是 的原因可能是 在水中的溶解度大于 在水中的溶解度大于 |
D.随着脱除反应的进行,吸收剂溶液的 逐渐减小 逐渐减小 |
您最近一年使用:0次
2023-08-16更新
|
162次组卷
|
10卷引用:北京大兴区2020届高三一模考试化学试题
北京大兴区2020届高三一模考试化学试题北京市顺义区第一中学2023-2024学年高一下学期3月月考化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题河南省三门峡市2021届高三10月阶段性考试化学试题辽宁省丹东市2021届高三上学期10月阶段测试化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题(已下线)专项特训2 非金属及其化合物对环境的影响黑龙江省齐齐哈尔市实验中学等3校2022-2023学年高三上学期11月期中考试化学试题山东省滕州市2023-2024学年高三上学期期中考试化学试题河南省周口恒大中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
10 . 向两份等体积、等浓度,pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法正确的是


| 实验 | 实验现象 |
| Ⅰ | 滴入V1mL NaClO溶液产生大量红褐色沉淀 |
| Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀 |
| A.曲线Ⅰ、Ⅱ起点a、d的pH不同,可能是因为溶液中Fe2+水解程度不同 |
| B.曲线Ⅰ、Ⅱ终点c、f的pH接近,可能是因为存在平衡:Fe(OH)3 ⇌ Fe3+ + 3OH- |
| C.a~b段pH降低,主要原因是:2Fe2+ + ClO-+ 5H2O= 2Fe(OH)3↓+ Cl-+ 4H+ |
| D.d~e段pH升高,主要原因是:ClO-+ H+= HClO、OH-+ H+= H2O |
您最近一年使用:0次
2023-06-02更新
|
270次组卷
|
2卷引用:北京市第五十五中学2023届高三保温卷化学试题



