21-22高三上·北京海淀·阶段练习
名校
解题方法
1 . 探究亚硝酸钠( NaNO2 )的化学性质,实验如下:
资料: AgNO2是淡黄色难溶于水的固体;由上述实验所得结论不正确的是
| 实验 | 装置 | 试剂a | 现象 |
| ① | 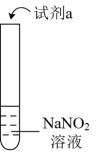 | 酚酞溶液 | 无色溶液变红 |
| ② | AgNO3溶液 | 产生淡黄色沉淀 | |
| ③ | 淀粉KI溶液+稀硫酸 | 无 色溶液立即变蓝 | |
| ④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
| A.NaNO2溶液显碱性 |
B.NaNO2可与某些盐发生复分解反应: +Ag+= AgNO2↓ +Ag+= AgNO2↓ |
C.NaNO2有氧化性: 2I- +2H++2 =I2+2NO2 ↑+H2O =I2+2NO2 ↑+H2O |
D.NaNO2有还原性: +3 +3 +8H+=3 +8H+=3 +2Cr3++4H2O +2Cr3++4H2O |
您最近一年使用:0次
2022-05-25更新
|
329次组卷
|
6卷引用:化学-2022年高考押题预测卷01(北京卷)
2 . 已知HNO2在低温下较稳定,酸性比醋酸略强,既有还原性又有氧化性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
| pH范围 | >7 | <7 |
| 产物 |  | NO、N2O、N2中的一种 |
A.碱性条件下,NaNO2与NaClO反应的离子方程式为 + ClO- = + ClO- = +Cl- +Cl- |
| B.向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,若溶液变蓝色,则证明氧化性:HNO2>I2 |
| C.向冷的NaNO2溶液中通入SO2最终可得到HNO2 |
| D.低温时不用其他试剂即可区分HNO2溶液与Na2CO3溶液 |
您最近一年使用:0次
2022-01-22更新
|
132次组卷
|
2卷引用: 山西省太原市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
3 . 已知 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
 在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是
在低温下较稳定,酸性比醋酸略强,既有氧化性又有还原性,其氧化产物、还原产物与溶液pH的关系如下表。下列有关说法错误的是| pH范围 | >7 | <7 |
| 产物 |  | NO、 、 、 中的一种 中的一种 |
A.碱性条件下, 与NaClO反应的离子方程式为 与NaClO反应的离子方程式为 |
B.向冷的 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
C.向冷的 溶液中通入 溶液中通入 可得到 可得到 |
D.低温时不用其它试剂即可区分 溶液与 溶液与 溶液 溶液 |
您最近一年使用:0次
2021-10-28更新
|
85次组卷
|
8卷引用:湖南省衡阳市衡东县第一中学2022届高三下学期第二次月考化学试题
名校
解题方法
4 . 利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色近白色难溶于水的固体),对现象的描述或解释有错误的是
| 实验 | 装置 | 试剂a | 现象 |
| ① | 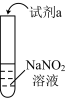 | 酚酞 | 无色溶液变红 |
| ② | AgNO3溶液 | 产生淡黄色近白色沉淀 | |
| ③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
| ④ | 酸性K2Cr2O7溶液 | 溶液变为绿色 |
A.NaNO2溶液呈碱性:NO +H2O ⇌HNO2+OH- +H2O ⇌HNO2+OH- |
B.NaNO2可与某些盐发生复分解反应:NO +Ag+=AgNO2↓ +Ag+=AgNO2↓ |
C.NaNO2具有氧化性:2I-+2H++2NO =I2+2NO2↑+H2O =I2+2NO2↑+H2O |
D.NaNO2具有还原性:Cr2O +3NO +3NO +8H+=3NO +8H+=3NO +2Cr3++4H2O +2Cr3++4H2O |
您最近一年使用:0次
2021-01-12更新
|
586次组卷
|
12卷引用:四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题
四川省成都市第七中学2023届高三上学期零诊模拟考试化学试题2020届高三化学海淀区高三第一学期期中练习北京市海淀区2019-2020学年高三期中考试化学试题重庆南开中学高2020届高三11月月考理综化学试题山西省长治市第二中学2019-2020学年高二上学期12月月考化学试题(已下线)考点24 元素与理论综合——《备战2020年高考精选考点专项突破题集》重庆市南开中学2020届高三年级网课学习能力自测理科综合化学试题浙江省诸暨市2019-2020学年高二上学期期末考试化学试题天津市第四十七中学2020~2021学年高三模拟考试化学试题北京师范大学附属中学2023-2024学年高三上学期10月月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期期中考试前练习化学试题天津北京师范大学静海附属学校 (天津市静海区北师大实验学校)2023-2024学年高三上学期第二次阶段检测(期中)化学试题
名校
5 . ClO2 具有很强的氧化性,是一种消毒杀菌效率高、二次污染小的水处理剂。
①实验室可通过以下反应制得 ClO2:(①、②两步反应方程式有物质未填及未配平)
 ;
;
②KClO3 和浓盐酸在一定温度下反应会生成黄色的易爆物 ClO2:
 ;
;
下列说法不正确的是
①实验室可通过以下反应制得 ClO2:(①、②两步反应方程式有物质未填及未配平)
 ;
;②KClO3 和浓盐酸在一定温度下反应会生成黄色的易爆物 ClO2:
 ;
;下列说法不正确的是
| A.KClO3 在反应①、②中均是作氧化剂,并且 1 个 KClO3 得到 1 个电子 |
| B.反应①中,a = d = f = g,物质 M 是 H2O,CO2 是氧化产物 |
| C.反应②中,氧化剂和还原剂的个数比为 5:1,且浓盐酸体现了还原性和酸性 |
| D.ClO2 的消毒能力(以单个分子得到的电子数表示)是 Cl2 的 2.63 倍(保留小数点后 2 位) |
您最近一年使用:0次
2022-12-21更新
|
252次组卷
|
2卷引用:重庆市巴蜀中学2022-2023学年高一上学期期中考试化学试题
名校
6 . 已知高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,反应如下:MnO +Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
+Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
 +Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是
+Fe2++H+→Fe3++Mn2++H2O(未配平)。下列说法正确的是A.MnO 是氧化剂,Fe3+是还原产物 是氧化剂,Fe3+是还原产物 | B.生成四个水分子时,转移10个电子 |
| C.硫酸体现了氧化性和酸性 | D.Fe2+的还原性强于Mn2+ |
您最近一年使用:0次
2022-11-09更新
|
163次组卷
|
2卷引用:浙江省A9协作体2022-2023学年高一上学期期中联考化学试题
名校
7 . 高铜酸钾是一种难溶于水的黑色粉末状固体,与高铁酸钾性质相似。可以由四羟基合铜酸钾和次溴酸在冰水浴中合成:①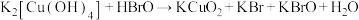 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
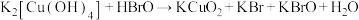 (未配平)。高铜酸钾在酸性条件下不稳定:②
(未配平)。高铜酸钾在酸性条件下不稳定:② (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是| A.①中氧化剂和还原剂的物质的量之比为1:2 |
B.②若有标况下5.6L 生成,转移电子 生成,转移电子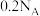 |
C.②中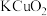 既表现氧化性,又表现还原性 既表现氧化性,又表现还原性 |
D.由①②可知氧化性强弱顺序为: |
您最近一年使用:0次
2022-06-07更新
|
962次组卷
|
6卷引用:山东省德州市2022届高考三模化学试题
山东省德州市2022届高考三模化学试题(已下线)1.3.2 氧化性、还原性强弱的判断(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)第03讲 氧化还原反应(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题宁夏平罗中学2022-2023学年高三上学期第一次月考化学试题
2022高三·全国·专题练习
8 . 化学上常用标准电极电势φ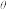 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ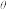 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ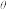 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
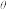 (氧化型/还原型)比较物质氧化能力。φ
(氧化型/还原型)比较物质氧化能力。φ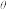 值越高,氧化型物质的氧化能力越强,φ
值越高,氧化型物质的氧化能力越强,φ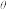 值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是
值与体系的pH有关。利用表格所给的数据分析,以下说法错误的是| 氧化型/还原型 | φ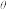 (Co3+/Co2+) (Co3+/Co2+) | φ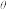 (HClO/Cl-) (HClO/Cl-) |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φ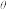 [Co(OH)3/Co(OH)2] [Co(OH)3/Co(OH)2] | φ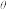 (ClO-/Cl-) (ClO-/Cl-) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
9 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2298次组卷
|
14卷引用:河南省信阳市2022届高三第二次质量检测化学试题
河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
2021·江苏·三模
名校
10 . 高铁酸钾(K2FeO4)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾能溶于水,微溶于浓KOH溶液,且能与水反应放出氧气,并生成Fe(OH)3胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4等。工业上湿法制备K2FeO4的流程如下:

下列关于K2FeO4的工业湿法制备工艺,说法正确的是

下列关于K2FeO4的工业湿法制备工艺,说法正确的是
| A.“反应”时,氧化剂和还原剂的物质的量之比为2:3 |
B.“过滤I”所得滤液中大量存在的离子有:Na+、Fe3+、Cl-、NO 、FeO 、FeO |
| C.“转化”时,反应能进行的原因是该条件下K2FeO4的溶解度比Na2FeO4小 |
| D.“过滤II”所得滤液在酒精灯外焰上灼烧,观察到火焰呈黄色,说明滤液为NaOH溶液 |
您最近一年使用:0次
2021-05-08更新
|
1232次组卷
|
11卷引用:解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)
(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)微专题14 氢氧化亚铁、高铁酸盐的制备实验探究-备战2023年高考化学一轮复习考点微专题(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)江苏省七市(南通、扬州、泰州、淮安、徐州、宿迁、连云港)2021届高三第三次调研考试化学试题江苏省苏州市木渎高级中学、苏州实验中学、苏州新区一中2020-2021学年高一下学期联合调研化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省如皋中学2021-2022学年高三上学期第一次阶段考试化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)山东省枣庄市2022-2023学年高三下学期二模考试化学试题变式题(选择题6-10)(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)



