名校
解题方法
1 . 取一定量加碘食盐(可能含 、KI、
、KI、 等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下
等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下 能氧化
能氧化 ,碱性或中性条件下
,碱性或中性条件下 不能氧化
不能氧化 )
)
(1)配制一定质量分数的加碘盐溶液的下列操作正确的是_______ 。_______ ,实验Ⅱ中红色物质的化学名称为_______ 。
(3)实验Ⅲ中溶液不变色,说明加碘食盐_______ (填“含”或“不含”)KI。
(4)有同学认为该加碘盐中可能含 ,设计实验方案检验是否含
,设计实验方案检验是否含
_______ 。
(5)加碘盐中若含KI,在潮湿空气中易引起碘的损失,为提高其稳定性,可加适量稳定剂,以减少碘的损失,下列物质可以作为稳定剂的是_______。
(6)为测定加碘盐中 的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的
的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的 标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中
标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中 含量为
含量为_______ mg/kg。(列出计算表达式,已知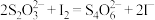 ,忽略测定过程中微量
,忽略测定过程中微量 的干扰)
的干扰)
(7)有同学认为可以直接用 溶液检测
溶液检测 的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
设计该实验的目的是_______ 。
 、KI、
、KI、 等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下
等),加蒸馏水溶解,分成几份对加碘食盐的组成进行实验测定。(已知酸性条件下 能氧化
能氧化 ,碱性或中性条件下
,碱性或中性条件下 不能氧化
不能氧化 )
)| 实验 | 现象 |
Ⅰ.取一份溶液,滴加少量稀硫酸酸化,加入足量KI固体,加入适量 振荡,静置 振荡,静置 | 加入足量KI固体,溶液显淡黄色,加入 振荡静置后下层溶液显紫红色 振荡静置后下层溶液显紫红色 |
| Ⅱ.另取一份溶液滴加KSCN溶液 | 溶液显红色 |
| Ⅲ.另取一份溶液滴加淀粉溶液,并滴加少量稀硫酸 | 溶液不变色 |
a.  b.
b.  c.
c.  d.
d. 
(3)实验Ⅲ中溶液不变色,说明加碘食盐
(4)有同学认为该加碘盐中可能含
 ,设计实验方案检验是否含
,设计实验方案检验是否含
(5)加碘盐中若含KI,在潮湿空气中易引起碘的损失,为提高其稳定性,可加适量稳定剂,以减少碘的损失,下列物质可以作为稳定剂的是_______。
A. | B. | C. | D. |
 的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的
的含量,实验小组称取x g加碘盐,加蒸馏水溶解,滴加适量稀盐酸和几滴淀粉溶液,并加入足量KI固体,充分反应后,用a mol/L的 标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中
标准溶液进行滴定,消耗VmL标准溶液,则加碘盐中 含量为
含量为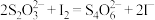 ,忽略测定过程中微量
,忽略测定过程中微量 的干扰)
的干扰)(7)有同学认为可以直接用
 溶液检测
溶液检测 的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:
的存在,并根据反应溶液蓝色出现的时间来衡量反应速率,实验记录如下:| 含淀粉和稀盐酸的加碘盐溶液/mL | 0.01mol/L的 溶液/mL 溶液/mL | 加水体积/mL | 实验温度/℃ | 出现蓝色时间/s | |
| 实验1 | 15 | 5 | 25 | 25 | |
| 实验2 | 15 |  | 30 | 25 | |
| 实验3 | 15 | 5 |  | 0 |
您最近一年使用:0次
2023-02-24更新
|
481次组卷
|
3卷引用:预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)
(已下线)预测卷05-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)湖北省华中师范大学第一附属中学等高考联盟2023届高三下学期2月联考化学试题陕西省安康市高新中学2023-2024学年高三下学期2月月考理综试题-高中化学
2 . 亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________ .
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________ 。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______ 千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________ (填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________ 。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
该样品中亚硝酸钠的质量分数为_________ .(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)
(1)NaNO2 中 N 元素的化合价为
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
您最近一年使用:0次
2018-04-10更新
|
446次组卷
|
3卷引用:2018年高考题及模拟题汇编 专题13 元素及其化合物知识的综合应用
2023高三·全国·专题练习
解题方法
3 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药、染料和盐类。我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:① ;②
;②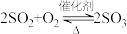 ;③
;③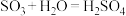 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关焦硫酸的说法
、质量分数为98%的浓硫酸。下列有关焦硫酸的说法正确 的是
 ;②
;②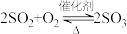 ;③
;③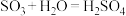 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为1.84 g⋅cm
),将焦硫酸稀释后可制得密度为1.84 g⋅cm 、质量分数为98%的浓硫酸。下列有关焦硫酸的说法
、质量分数为98%的浓硫酸。下列有关焦硫酸的说法A.焦硫酸钠( )的水溶液呈酸性 )的水溶液呈酸性 |
| B.焦硫酸具有强还原性 |
C.浓硫酸吸收 生成焦硫酸的变化是物理变化 生成焦硫酸的变化是物理变化 |
D.焦硫酸钠( )可与酸性氧化物反应生成新盐 )可与酸性氧化物反应生成新盐 |
您最近一年使用:0次
名校
解题方法
4 . 一种利用低品位铜矿( 、CuS、FeO和
、CuS、FeO和 等)为原料制取CuCl的工艺流程如下:
等)为原料制取CuCl的工艺流程如下:
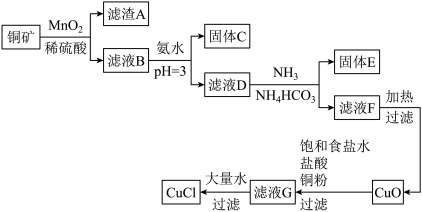
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时, 的溶度积常数
的溶度积常数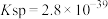 。
。
(1)铜矿中被 氧化的物质有
氧化的物质有_______ 。
(2)滤液D中铁离子的浓度约为_______ ,向滤液D中先通氨气的目的_______ 。
(3)固体E主要是 ,生成
,生成 的离子方程式是
的离子方程式是_______ 。
(4)滤液F加热生成 、
、 和CuO,反应的化学方程式是
和CuO,反应的化学方程式是_______ 。
(5)查阅资料:+1价Cu和 可以形成2种配离子
可以形成2种配离子 和
和 。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成
。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成_______ 。
(6)CuCl质量分数的测定
称取mg样品,溶于25mL过量的硫酸铁铵溶液( 将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与
将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与 发生特征反应,溶液呈红棕色),用含
发生特征反应,溶液呈红棕色),用含 的硫酸铁铈标准液滴定
的硫酸铁铈标准液滴定 ,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式_______ 。
 、CuS、FeO和
、CuS、FeO和 等)为原料制取CuCl的工艺流程如下:
等)为原料制取CuCl的工艺流程如下:
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,
 的溶度积常数
的溶度积常数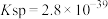 。
。(1)铜矿中被
 氧化的物质有
氧化的物质有(2)滤液D中铁离子的浓度约为
(3)固体E主要是
 ,生成
,生成 的离子方程式是
的离子方程式是(4)滤液F加热生成
 、
、 和CuO,反应的化学方程式是
和CuO,反应的化学方程式是(5)查阅资料:+1价Cu和
 可以形成2种配离子
可以形成2种配离子 和
和 。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成
。滤液G加大量水析出CuCl沉淀,从平衡移动角度分析,滤液G中的配离子是哪种更有利于CuCl的生成(6)CuCl质量分数的测定
称取mg样品,溶于25mL过量的硫酸铁铵溶液(
 将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与
将+1价Cu氧化),滴加2滴试亚铁灵指示剂(与 发生特征反应,溶液呈红棕色),用含
发生特征反应,溶液呈红棕色),用含 的硫酸铁铈标准液滴定
的硫酸铁铈标准液滴定 ,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
,共消耗硫酸铁铈标准液VmL,则CuCl质量分数的计算式
您最近一年使用:0次
2023-03-17更新
|
544次组卷
|
6卷引用:河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(工业流程题)
(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(工业流程题)(已下线)专题20 工艺流程题北京市石景山区2022-2023学年高三下学期质量监控(零模)化学试题北京市石景山区2023-2024学年高三上学期一模考试化学试题北京市第一六一中学2023-2024学年高三下学期开学考化学试题北京市中国人民大学附属中学丰台学校2023-2024学年高三上学期12月月考化学试题
5 . 研究发现“利用零价铁还原 可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与
可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与 溶液的反应。实验步骤有如下五步:
溶液的反应。实验步骤有如下五步:
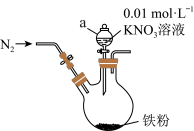
①打开弹簧夹,缓慢通入 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行。
氛围中进行。
②加入pH已调至2.5的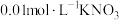 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
③连接好装置,并检查装置的气密性。
④检测到滤液中存在 、
、 和
和 。
。
⑤装好药品。
⑥过滤剩余固体时,表面的白色物质变为红褐色。
请回答下列问题:
(1)仪器a的名称是___________ 。
(2)通入 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是___________ 。
(3)实验步骤的正确顺序是___________ 。
(4)白色物质是___________ ,白色物质变为红褐色的化学方程式为___________ :检验滤液中 所用的试剂是
所用的试剂是___________ 。
(5)某地下废水中 的含量测定。取VL废水,加入稀硫酸酸化,再加入
的含量测定。取VL废水,加入稀硫酸酸化,再加入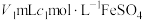 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用 标准溶液滴定剩余的
标准溶液滴定剩余的 ,消耗
,消耗 标准溶液的体积为
标准溶液的体积为 ,终点时的现象是
,终点时的现象是___________ 。
 可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与
可脱除地下废水中硝酸盐”,某课外活动小组利用如下装置探究铁粉与 溶液的反应。实验步骤有如下五步:
溶液的反应。实验步骤有如下五步: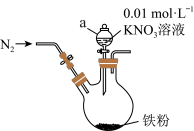
①打开弹簧夹,缓慢通入
 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行。
氛围中进行。②加入pH已调至2.5的
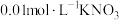 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现剩余固体表面有少量白色物质附着。③连接好装置,并检查装置的气密性。
④检测到滤液中存在
 、
、 和
和 。
。⑤装好药品。
⑥过滤剩余固体时,表面的白色物质变为红褐色。
请回答下列问题:
(1)仪器a的名称是
(2)通入
 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是(3)实验步骤的正确顺序是
(4)白色物质是
 所用的试剂是
所用的试剂是(5)某地下废水中
 的含量测定。取VL废水,加入稀硫酸酸化,再加入
的含量测定。取VL废水,加入稀硫酸酸化,再加入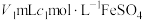 标准溶液(过量),充分反应后,用
标准溶液(过量),充分反应后,用 标准溶液滴定剩余的
标准溶液滴定剩余的 ,消耗
,消耗 标准溶液的体积为
标准溶液的体积为 ,终点时的现象是
,终点时的现象是
您最近一年使用:0次
名校
6 . 实验小组探究SO2与Na2O2的反应。向盛有SO2的烧瓶中加入Na2O2固体,测得反应体系中O2含量的变化如图。

下列说法不正确 的是

下列说法
| A.有O2生成推测发生了反应:2Na2O2+2SO2=2Na2SO3+O2 |
| B.bc段O2含量下降与反应O2+2Na2SO3=2Na2SO4有关 |
| C.可用HNO3酸化的BaCl2溶液检验b点固体中是否含有Na2SO4 |
| D.产物Na2SO4也可能是SO2与Na2O2直接化合生成的 |
您最近一年使用:0次
2023-03-31更新
|
1050次组卷
|
10卷引用:选择题11-14
2023高三·全国·专题练习
7 . 一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应式:  +6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
+6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为_______ %。
 +6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
+6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
8 . 葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验:
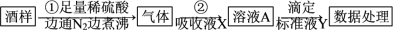
已知还原性:SO >I->Cl-。请按要求回答下列问题:
>I->Cl-。请按要求回答下列问题:
(1)葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的_______ 性。
(2)反应①的离子方程式为_______ 。边通N2边煮沸的目的是_______ 。
(3)若吸收液X选择NaOH溶液,滴定前,在溶液A中需先添加试剂_______ ,调pH至微酸性,再添加试剂_______ ,此时选择酸性KIO3溶液作标准液Y进行滴定。
(4)若吸收液X选择氯水(假设溶质仅含Cl2),反应②的离子方程式为_______ ;而标准液Y选择NaOH溶液(含酚酞),此方案不可行的原因是:_______ (写出一种即可,可用离子反应方程式表示)。只需将上述方案中的吸收液X改为_______ ,方案即可实施。
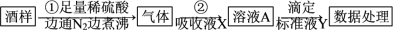
已知还原性:SO
 >I->Cl-。请按要求回答下列问题:
>I->Cl-。请按要求回答下列问题:(1)葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的
(2)反应①的离子方程式为
(3)若吸收液X选择NaOH溶液,滴定前,在溶液A中需先添加试剂
(4)若吸收液X选择氯水(假设溶质仅含Cl2),反应②的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 已知 与
与 溶液发生反应Ⅰ:
溶液发生反应Ⅰ: ;
; 与酸化的
与酸化的 溶液发生反应Ⅱ:
溶液发生反应Ⅱ: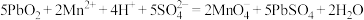 ,下列推断错误的是
,下列推断错误的是
 与
与 溶液发生反应Ⅰ:
溶液发生反应Ⅰ: ;
; 与酸化的
与酸化的 溶液发生反应Ⅱ:
溶液发生反应Ⅱ: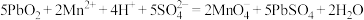 ,下列推断错误的是
,下列推断错误的是A.由反应Ⅰ可知, 中 中 (Ⅱ)和 (Ⅱ)和 (Ⅳ)含量之比为 (Ⅳ)含量之比为 |
B.由反应Ⅰ、Ⅱ可知,氧化性: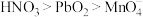 |
C. 可与盐酸发生反应: 可与盐酸发生反应: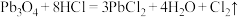 |
D. 可与稀硝酸发生反应: 可与稀硝酸发生反应: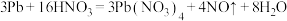 |
您最近一年使用:0次
10 . 甲酸钙[(HCOO)2Ca]是一种新型猪饲料添加剂。实验室制取甲酸钙方法之一,是将Ca(OH)2和甲醛溶液依次加入质量分数为30%~70%的H2O2中。下列说法错误的是
| A.反应温度不宜过高 |
| B.该反应中被还原的元素只有O |
| C.参加反应的氧化剂与还原剂的物质的量之比为1:1 |
| D.每生成26 g (HCOO)2Ca,反应转移电子的物质的量为0.4 mol |
您最近一年使用:0次
2022-01-08更新
|
1150次组卷
|
5卷引用:专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)
(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)河南省郑州市2022届高三上学期第一次质量预测(1月)化学试题河南省焦作第一中学2023-2024学年高三上学期10月模拟化学测试



