2024高三·全国·专题练习
解题方法
1 . 化学需氧量(COD)是指用强氧化剂将1 L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以O2为氧化剂时所消耗O2的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一,Fenton(Fe2+/H2O2)法能产生Fe3+和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为___________ 。
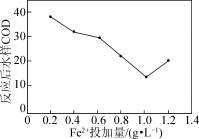
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是___________ 。 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。 的使用范围更广。SO
的使用范围更广。SO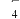 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:___________ 。
② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):___________ mol。
③利用该复合材料催化活化S2O 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为___________ 。
(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200 mL,加入200 mL H2O2,改变起始投加FeSO4·7H2O的量,反应相同时间。测得反应后水样COD随Fe2+投加量的关系如图所示。当Fe2+投加量超过1 g·L-1时,反应后水样COD不降反升的原因可能是
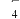 )的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O
)的氧化技术引起关注。研究发现,一种Mn3O4石墨烯纳米复合材料对催化活化S2O 产生SO
产生SO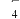 具有很好的效果。S2O
具有很好的效果。S2O 结构如图所示。
结构如图所示。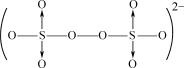
 的使用范围更广。SO
的使用范围更广。SO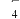 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:② 一种制取Mn3O4—石墨烯纳米复合材料的物种转化关系可表示如下(GO表示石墨烯):
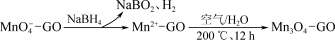
③利用该复合材料催化活化S2O
 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为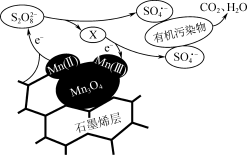
您最近一年使用:0次
2024高三·全国·专题练习
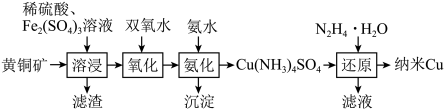
2 . 铜是人类最早使用的金属,在生产生活中有着重要的应用。一种以黄铜矿(主要成分为CuFeS2,含少量Fe的氧化物、SiO2、Au等)为原料制备纳米Cu的工艺流程如下:
②Cu2++4NH3 [Cu(NH3)4]2+。
[Cu(NH3)4]2+。
③Cu2+在一定条件下可能与铜反应转化为Cu+。
回答下列问题:
(1)为了提高“溶浸”的浸出率,可采取的措施有___________ (填两条即可)。
(2)溶浸后,滤渣的主要成分为Au、SiO2、___________ (填化学式)。
(3)写出加入双氧水氧化时反应的离子方程式:___________ 。
(4)加入N2H4·H2O “还原”,产生一种气体单质,该气体的结构式为___________ 。
若加入N2H4·H2O的量不足时,生成另一种还原产物(属于氧化物),该产物的化学式为___________ 。
(5)保持其他条件相同,分别测得纳米Cu的产率随c(N2H4·H2O)和pH变化的曲线如图。___________ 。
②pH过大,纳米Cu的产率反而下降的原因可能是___________ 。
②Cu2++4NH3
 [Cu(NH3)4]2+。
[Cu(NH3)4]2+。③Cu2+在一定条件下可能与铜反应转化为Cu+。
回答下列问题:
(1)为了提高“溶浸”的浸出率,可采取的措施有
(2)溶浸后,滤渣的主要成分为Au、SiO2、
(3)写出加入双氧水氧化时反应的离子方程式:
(4)加入N2H4·H2O “还原”,产生一种气体单质,该气体的结构式为
若加入N2H4·H2O的量不足时,生成另一种还原产物(属于氧化物),该产物的化学式为
(5)保持其他条件相同,分别测得纳米Cu的产率随c(N2H4·H2O)和pH变化的曲线如图。

②pH过大,纳米Cu的产率反而下降的原因可能是
您最近一年使用:0次
23-24高三下·江西宜春·阶段练习
名校
解题方法
3 . 我国的钴(Co)资源非常贫乏,一种利用湿法炼锌净化渣回收钴的工艺如下图所示。已知净化渣含有较高的锌、铜、铅、钴元素以及一定量的铁和锰元素,它们大多以金属单质和氧化物的形式存在。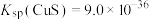 ,
, ,
, 。
。
② 在酸性溶液中有强氧化性
在酸性溶液中有强氧化性
(1)“常压浸出”需加热至70℃左右,宜采用___________ (填序号;①盐酸②硫酸③硝酸)进行酸浸,浸出渣主要成分为___________ 。
(2)大多数金属硫化物都难溶于水,能选择 除铜的原因是
除铜的原因是___________ ,若加入 后溶液中
后溶液中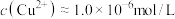 ,
,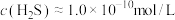 ,则溶液的pH约为
,则溶液的pH约为___________ 。
(3)过二硫酸钠( )氧化Mn2+生成MnO2沉淀,同时生成
)氧化Mn2+生成MnO2沉淀,同时生成 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:___________ 。
(4)根据流程可知:在“沉淀分离”步骤中,还原性Co2+___________ Mn2+(填“强于”或“弱于”);氧化沉淀所得产物为Co(OH)3,最终钴产品是Co(OH)3脱水后的产物,脱水前后质量比为55:46,则钴产品的化学式为___________ 。

 ,
, ,
, 。
。②
 在酸性溶液中有强氧化性
在酸性溶液中有强氧化性(1)“常压浸出”需加热至70℃左右,宜采用
(2)大多数金属硫化物都难溶于水,能选择
 除铜的原因是
除铜的原因是 后溶液中
后溶液中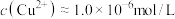 ,
,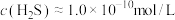 ,则溶液的pH约为
,则溶液的pH约为(3)过二硫酸钠(
 )氧化Mn2+生成MnO2沉淀,同时生成
)氧化Mn2+生成MnO2沉淀,同时生成 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:(4)根据流程可知:在“沉淀分离”步骤中,还原性Co2+
您最近一年使用:0次
4 . 某小组同学探究硫代硫酸钠(Na2S2O3)溶液与某些常见金属离子的反应。
已知:i.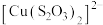 (淡绿色)、
(淡绿色)、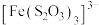 (紫黑色)、
(紫黑色)、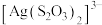 (无色)
(无色)
ii. 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。
iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是___________ 。
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
①取I中的浊液,离心分离,经检验,沉淀是Cu2S和S的混合物,清液中存在 。
。
i.补全I中生成黑色沉淀的总反应的离子方程式:___________
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+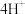
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是___________ 。
②Ⅱ中, 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了 ,理由是
,理由是___________ 。
ii.补全实验方案证实上述结论:将沉淀1洗净,___________ 。
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是___________ 。
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸, 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,___________ 是更软的酸。
已知:i.
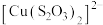 (淡绿色)、
(淡绿色)、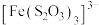 (紫黑色)、
(紫黑色)、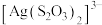 (无色)
(无色)ii.
 在酸性溶液中转化为
在酸性溶液中转化为 、S和SO2。
、S和SO2。iii.BaS4O6可溶于水、BaS2O3微溶于水。
(1)将S粉加入沸腾的Na2SO3溶液中可制得Na2S2O3,离子方程式是
(2)研究 Na2S2O3与某些常见金属离子的反应,进行如下实验。
| 序号 | X溶液 | 现象 |
| I | CuCl2溶液 | 溶液变为淡绿色,水浴加热至50℃以上,逐渐析出黑色沉淀 | |
| Ⅱ | FeCl3溶液 | 溶液变为紫黑色,片刻后溶液变为无色 | |
| Ⅲ | AgNO3溶液 | 逐滴加入AgNO3溶液,生成白色沉淀,振荡后沉淀溶解,得无色溶液 |
 。
。i.补全I中生成黑色沉淀的总反应的离子方程式:
 □___________
□___________ □___________
□___________ □___________
□___________ □___________+
□___________+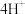
ii.查阅资料可知,常温时,生成黑色沉淀反应的平衡常数很大,但仍需水浴加热至50℃以上才出现沉淀,原因是
②Ⅱ中,
 被Fe3+氧化的主要产物是
被Fe3+氧化的主要产物是 ,还有很少量的
,还有很少量的 。取Ⅱ中的无色溶液进行如下实验证实了此结论。
。取Ⅱ中的无色溶液进行如下实验证实了此结论。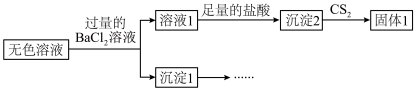
i.仅由溶液1中加入足量的盐酸后得到沉淀2,不能说明Ⅱ中生成了
 ,理由是
,理由是ii.补全实验方案证实上述结论:将沉淀1洗净,
③向Ⅲ的无色溶液中继续加入0.5mL 0.1mol·L-1AgNO3溶液,产生白色沉淀Ag2S2O3。静置,得到黑色沉淀Ag2S,同时生成强酸。生成Ag2S的化学方程式是
(3)软硬酸碱原理认为,Ⅲ中, Ag+为软酸,
 为软碱, S2-是比
为软碱, S2-是比 更软的碱,可解释
更软的碱,可解释 与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
与Ag+反应的最终产物为Ag2S。由此推测,Ⅰ中, Cu+和Cu2+,
您最近一年使用:0次
2024·湖南·一模
名校
解题方法
5 . 下列反应的离子方程式书写正确的是
A.碘化亚铁溶液中通入足量的氯气: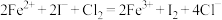 |
B.加碘盐与药物碘化钾片尽量不要同时服用: |
C.向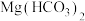 溶液中加入过量的NaOH溶液: 溶液中加入过量的NaOH溶液: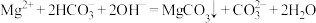 |
D.向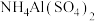 溶液中滴入 溶液中滴入 使 使 反应完全: 反应完全: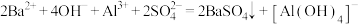 |
您最近一年使用:0次
2024-04-27更新
|
1102次组卷
|
4卷引用:题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)
(已下线)题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)湖南省“一起考”大联考2023-2024学年高三下学期3月模拟考试(模拟一)化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 2024届江西省吉安市第一中学高三下学期一模化学试题
2024高三下·全国·专题练习
解题方法
6 .  具有强氧化性,可发生反应:
具有强氧化性,可发生反应:

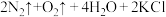 。下列说法不正确的是
。下列说法不正确的是
 具有强氧化性,可发生反应:
具有强氧化性,可发生反应:

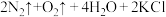 。下列说法不正确的是
。下列说法不正确的是A. 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
B. 仅作氧化剂 仅作氧化剂 |
C.生成1mol 转移电子的物质的量为5mol 转移电子的物质的量为5mol |
D.实验室不可用加热 固体的方法制备 固体的方法制备 |
您最近一年使用:0次
2024高三下·全国·专题练习
7 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:
Ⅱ.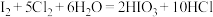 ;
;
Ⅲ.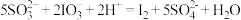 ;
;
方案甲中,根据I2的特性,分离操作X的名称是________ 。
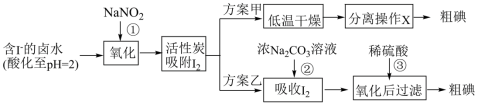
Ⅱ.
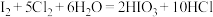 ;
;Ⅲ.
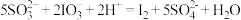 ;
;方案甲中,根据I2的特性,分离操作X的名称是
您最近一年使用:0次
8 . 混盐是由一种金属阳离子(或 )与两种酸根阴离子组成的盐,如
)与两种酸根阴离子组成的盐,如 可看成由
可看成由 和
和 组成。向混盐
组成。向混盐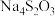 中加入足量稀硫酸,发生如下反应:
中加入足量稀硫酸,发生如下反应: 。下列说法正确的是
。下列说法正确的是
 )与两种酸根阴离子组成的盐,如
)与两种酸根阴离子组成的盐,如 可看成由
可看成由 和
和 组成。向混盐
组成。向混盐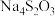 中加入足量稀硫酸,发生如下反应:
中加入足量稀硫酸,发生如下反应: 。下列说法正确的是
。下列说法正确的是A.混盐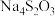 可看成由 可看成由 和 和 组成 组成 |
B.混盐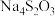 固体中阴阳离子个数比为 固体中阴阳离子个数比为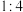 |
C.向混盐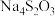 溶液中加入 溶液中加入 溶液,可生成 溶液,可生成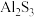 沉淀 沉淀 |
D.向混盐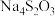 溶液中加入足量稀 溶液中加入足量稀 ,每产生 ,每产生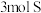 ,转移电子的物质的量为 ,转移电子的物质的量为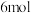 |
您最近一年使用:0次
2024·安徽淮北·一模
9 .  与浓硫酸在一定条件下可发生反应:
与浓硫酸在一定条件下可发生反应: (方程式未配平),下列说法正确的是
(方程式未配平),下列说法正确的是
 与浓硫酸在一定条件下可发生反应:
与浓硫酸在一定条件下可发生反应: (方程式未配平),下列说法正确的是
(方程式未配平),下列说法正确的是A.X为 | B. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
| C.浓硫酸表现出了氧化性和酸性 | D. 发生反应时转移电子 发生反应时转移电子 |
您最近一年使用:0次
2024·广东梅州·一模
10 . 下图为氯及其化合物的“价-类”二维图。下列说法不正确的是

| A.a物质是由离子构成的 |
B. 、 、 的物质间转化均能一步反应实现 的物质间转化均能一步反应实现 |
| C.c可作为自来水消毒剂是因为其具有强氧化性 |
D.d分子中形成的共价键为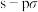 键和 键和 |
您最近一年使用:0次