名校
1 . 硼单质及其化合物有重要的应用。硼晶体熔点为2076℃,可形成多种卤化物。 可与
可与 反应生成
反应生成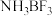 。
。 可与
可与 反应生成乙硼烷
反应生成乙硼烷 (标准燃烧热为
(标准燃烧热为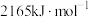 ),其分子中一个硼与周围的四个氢形成正四面体,结构式为
),其分子中一个硼与周围的四个氢形成正四面体,结构式为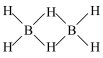 ,具有还原性。乙硼烷易水解生成
,具有还原性。乙硼烷易水解生成 与
与 ,
, 是一种一元弱酸,可作吸水剂。乙硼烷可与
是一种一元弱酸,可作吸水剂。乙硼烷可与 反应生成氨硼烷(
反应生成氨硼烷(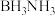 ),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成
),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成 ,是一种常用的还原剂。下列物质的结构、性质、用途之间
,是一种常用的还原剂。下列物质的结构、性质、用途之间
A.B电负性小于H, 可用作还原剂 可用作还原剂 | B. 有弱酸性,可用作吸水剂 有弱酸性,可用作吸水剂 |
C. 中B有空轨道,易与 中B有空轨道,易与 形成 形成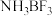 | D. 可以脱氢,可用作储氢材料 可以脱氢,可用作储氢材料 |
您最近一年使用:0次
2023-11-13更新
|
398次组卷
|
4卷引用:压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
(已下线)压轴题02 氧化还原反应的概念及规律(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)江苏省苏州市2023-2024学年高三上学期11月期中考试化学试题江苏省苏州市2023~2024学年高三上学期期中调研化学试题江苏省阜宁中学2023-2024学年高二上学期期末化学试卷
名校
解题方法
2 . 物质的性质决定用途,下列有关物质性质与用途均正确且两者具有对应关系的是
| A.晶体硅熔点高、硬度大,可用于制作半导体材料 |
B. 具有还原性,可用作葡萄酒抗氧化剂 具有还原性,可用作葡萄酒抗氧化剂 |
| C.银氨溶液具有弱还原性,可用于制作银镜 |
| D.明矾溶于水能形成胶体,可用于自来水的杀菌消毒 |
您最近一年使用:0次
2023-08-18更新
|
184次组卷
|
3卷引用:选择题1-5
3 . 周期表中VIIA元素及其化合物应用广泛。氢氟酸可用作雕刻玻璃;卤化银具有感光性( 的电离平衡常数分别为:
的电离平衡常数分别为: 、
、 ;HClO的电离平衡常数为:
;HClO的电离平衡常数为: )。下列物质性质与用途具有对应关系的是
)。下列物质性质与用途具有对应关系的是
 的电离平衡常数分别为:
的电离平衡常数分别为: 、
、 ;HClO的电离平衡常数为:
;HClO的电离平衡常数为: )。下列物质性质与用途具有对应关系的是
)。下列物质性质与用途具有对应关系的是| A.氢氟酸具有酸性,可用于雕刻玻璃 | B. 受热可分解,可用作食盐碘添加剂 受热可分解,可用作食盐碘添加剂 |
| C.碘化银具有感光性,可用于人工降雨 | D. 有强氧化性,可用作水体杀菌消毒剂 有强氧化性,可用作水体杀菌消毒剂 |
您最近一年使用:0次
解题方法
4 . 周期表中VIA族元素及其化合物应用广泛。 是常见的氧化剂和助燃剂。
是常见的氧化剂和助燃剂。 催化氧化是工业制硫酸的重要反应之一(中和热为
催化氧化是工业制硫酸的重要反应之一(中和热为 )。
)。 (硒)是重要的工业原材料与动物体必须营养素。提取
(硒)是重要的工业原材料与动物体必须营养素。提取 的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取
的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取 ,硫酸化焙烧提取
,硫酸化焙烧提取 的步骤主要分为两步:第一步焙烧,硫酸将单质
的步骤主要分为两步:第一步焙烧,硫酸将单质 氧化为
氧化为 。第二步还原吸收,在水中
。第二步还原吸收,在水中 将
将 转化为单质
转化为单质 。下列物质性质与用途具有对应关系的是
。下列物质性质与用途具有对应关系的是
 是常见的氧化剂和助燃剂。
是常见的氧化剂和助燃剂。 催化氧化是工业制硫酸的重要反应之一(中和热为
催化氧化是工业制硫酸的重要反应之一(中和热为 )。
)。 (硒)是重要的工业原材料与动物体必须营养素。提取
(硒)是重要的工业原材料与动物体必须营养素。提取 的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取
的主要原材料为电解铜产生的阳极泥。可通过阳极泥硫酸化焙烧提取 ,硫酸化焙烧提取
,硫酸化焙烧提取 的步骤主要分为两步:第一步焙烧,硫酸将单质
的步骤主要分为两步:第一步焙烧,硫酸将单质 氧化为
氧化为 。第二步还原吸收,在水中
。第二步还原吸收,在水中 将
将 转化为单质
转化为单质 。下列物质性质与用途具有对应关系的是
。下列物质性质与用途具有对应关系的是| A.二氧化硫具有还原性,可用作漂白剂 |
| B.硒在光照下导电性显著提高,可用作光敏材料 |
| C.臭氧能溶于水,可用作杀菌剂 |
| D.硫酸具有强氧化性,可用作干燥剂 |
您最近一年使用:0次
2021高一·全国·专题练习
5 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
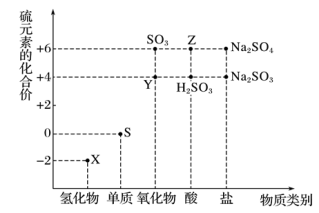
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
您最近一年使用:0次
6 . 某小组以4H++4I-+O2=2I2+2H2O为研究对象,探究影响氧化还原反应因素。
(1)实验Ⅳ的作用是______________ 。用CCl4萃取Ⅰ、Ⅱ、Ⅲ、Ⅳ的溶液,萃取后下层CCl4的颜色均无明显变化。
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了______________ 。
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。
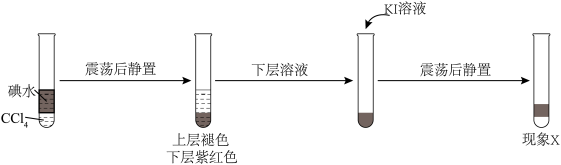
现象x是______________ 。
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是______________ 。
假设2:O2只氧化了SO2,化学方程式是______________ 。
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
结合化学反应,解释上表中的现象:______________ 。
(6)综合实验证据说明影响I-被氧化的因素及对应关系______________ 。
| 实验 | 气体a | 编号及现象 |
 | HCl | Ⅰ.溶液迅速呈黄色 |
| SO2 | Ⅱ.溶液较快呈亮黄色 | |
| CO2 | Ⅲ.长时间后,溶液呈很浅的黄色 | |
| 空气 | Ⅳ.长时间后,溶液无明显变化 |
(2)取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅲ的溶液变蓝;Ⅱ、Ⅳ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅲ中生成了
(3)查阅资料:I2易溶于KI溶液。下列实验证实了该结论并解释Ⅰ、Ⅲ的萃取现象。

现象x是
(4)针对Ⅱ中溶液未检出I2的原因,提出三种假设:
假设1:溶液中c(H+)较小。小组同学认为此假设不成立,依据是
假设2:O2只氧化了SO2,化学方程式是
假设3:I2不能在此溶液中存在。
(5)设计下列实验,验证了假设3,并继续探究影响氧化还原反应的因素。
i.取Ⅱ中亮黄色溶液,滴入品红,红色褪去。
ii.取Ⅱ中亮黄色溶液,加热,黄色褪去,经品红检验无SO2。加入酸化的AgNO3溶液,产生大量AgI沉淀,长时间静置,沉淀无明显变化。
iii.取Ⅱ中亮黄色溶液,控制一定电压和时间进行电解,结果如下。
| 电解时间/min | 溶液 | 阳极 | 阴极 |
| t1 | 黄色变浅、有少量SO42- | 检出I2,振荡后消失 | H2 |
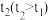 | 溶液无色、有大量SO42- | 检出I2,振荡后消失 | H2 |
(6)综合实验证据说明影响I-被氧化的因素及对应关系
您最近一年使用:0次
2019-12-21更新
|
337次组卷
|
2卷引用:2020届高考化学二轮复习大题精准训练——反应原理(历程)的探究式实验
名校
7 . 下表中“试剂”与“操作及现象”对应关系错误的是
| 选项 | 试剂 | 操作及现象 |
| A | AgNO3溶液 | 滴加氨水,产生沉淀;继续滴加氨水,沉淀溶解 |
| B | 铝粉 | 滴加NaOH溶液,产生气体;继续滴加,产生白色沉淀 |
| C | CuSO4溶液 | 加过量NaOH溶液,产生蓝色沉淀;再加乙醛,加热,产生红色沉淀 |
| D | 氯水 | 滴加NaOH溶液,溶液颜色褪去;再加HCl,溶液颜色恢复 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2018-10-25更新
|
279次组卷
|
3卷引用:考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编
解题方法
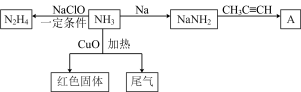
8 . 氨气用途非常广泛,以下是氨气的部分转化关系图。
②随着杂化轨道中s成分的增加,电子云更靠近原子核,核对电子的吸引力增强
(1) 又称联氨,不如氨气稳定,还原性强于氨气,与
又称联氨,不如氨气稳定,还原性强于氨气,与 反应释放出大量热、产物无污染、产生大量气体,可作为火箭推进剂。
反应释放出大量热、产物无污染、产生大量气体,可作为火箭推进剂。
①写出 用于火箭推进剂反应的化学方程式
用于火箭推进剂反应的化学方程式___________ 。
②从分子结构角度分析, 不如氨气稳定的原因是
不如氨气稳定的原因是___________ 。
(2)下列说法正确的是___________。
(3)结合已知信息,写出生成A的化学方程式___________ 。
(4)实验中在加热条件下通入过量的 与CuO反应,设计实验验证尾气中比较活泼的两种气体
与CuO反应,设计实验验证尾气中比较活泼的两种气体___________ 。

②随着杂化轨道中s成分的增加,电子云更靠近原子核,核对电子的吸引力增强
(1)
 又称联氨,不如氨气稳定,还原性强于氨气,与
又称联氨,不如氨气稳定,还原性强于氨气,与 反应释放出大量热、产物无污染、产生大量气体,可作为火箭推进剂。
反应释放出大量热、产物无污染、产生大量气体,可作为火箭推进剂。①写出
 用于火箭推进剂反应的化学方程式
用于火箭推进剂反应的化学方程式②从分子结构角度分析,
 不如氨气稳定的原因是
不如氨气稳定的原因是(2)下列说法正确的是___________。
A.以上转化关系中 只表现出还原性 只表现出还原性 |
| B.若CuO无剩余,红色固体的组分可能有三种情况 |
| C.制备氨基钠需在无水、无氧环境中进行 |
D.为了增加 的产量,往往加入过量的NaClO 的产量,往往加入过量的NaClO |
(3)结合已知信息,写出生成A的化学方程式
(4)实验中在加热条件下通入过量的
 与CuO反应,设计实验验证尾气中比较活泼的两种气体
与CuO反应,设计实验验证尾气中比较活泼的两种气体
您最近一年使用:0次
2023高三·全国·专题练习
9 . 氧化还原反应在工业生产、环保及科研中有广泛的应用,请根据以上信息,结合自己所掌握的化学知识,回答下列问题:
Ⅰ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成CuH。CuH具有的性质:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学方程式:___________ 。
(2)CuH溶解在稀盐酸中生成的气体是___________ (填化学式)。
(3)将CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:___________ 。
Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是___________ 。
(5)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应而被吸收,则 、Cl-、VO2+还原性由强到弱的顺序是
、Cl-、VO2+还原性由强到弱的顺序是___________ 。
Ⅰ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成CuH。CuH具有的性质:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学方程式:
(2)CuH溶解在稀盐酸中生成的气体是
(3)将CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
Ⅱ.钒性能优良,用途广泛,有金属“维生素”之称。完成下列填空:
(4)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(5)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应而被吸收,则
 、Cl-、VO2+还原性由强到弱的顺序是
、Cl-、VO2+还原性由强到弱的顺序是
您最近一年使用:0次
10 . 硫代硫酸钠又名大苏打、海波,易溶于水,不溶于醇,用途非常广泛,常用作氰化物中毒的解毒类药物。关于反应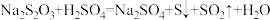 ,下列说法正确的是
,下列说法正确的是
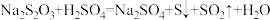 ,下列说法正确的是
,下列说法正确的是| A.H2SO4是氧化剂 |
| B.氧化产物与还原产物的物质的量之比为2∶1 |
| C.0.5molNa2S2O3发生反应,转移1mol电子 |
| D.Na2S2O3与稀硝酸也能发生类似反应 |
您最近一年使用:0次



