名校
解题方法
1 . 硫化细菌是好氧菌,而反硫化细菌是厌氧菌,两类细菌参与了土壤中硫循环。___________ 剂(填“氧化”或“还原”)。
(2)“硫化细菌浸矿法”可将矿石中的CuS转化为可溶性铜盐,离子方程式是___________ 。
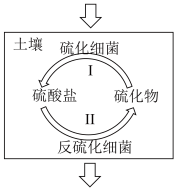
(2)“硫化细菌浸矿法”可将矿石中的CuS转化为可溶性铜盐,离子方程式是
您最近一年使用:0次
2 . 细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。_______ (填字母序号)。
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为_______ 。
(3)硝化过程中,含氮物质发生_______ (填“氧化”或“还原”)反应。
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为_______ mol。
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是______ 。上述过程中发生下列反应:3Fe2++ +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为_______ mg /L。(保留计算过程)
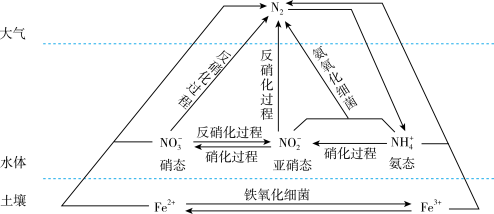
a.N2转化为氨态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中氨态氮的主要来源之一,氨气是生产氮肥的主要原料,工业合成氨的化学方程式为
(3)硝化过程中,含氮物质发生
(4)氨态氮与亚硝态氮可以在氨氧化细菌的作用下转化为氮气。该反应中,当产生0.02 mol 氮气时,转移的电子的物质的量为
(5)NO是大气污染气体,测定某气体样品中NO含量操作如下:将2L气样通入适量酸化的H2O2溶液中,使NO完全被氧化为
 。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为
。向上述反应后溶液中加入30 mL0.1 mol·L−1FeSO4溶液(过量),充分反应后,多余Fe2+与3.5 mL、0.1 mol·L−1K2Cr2O7恰好反应。NO被H2O2氧化为 的离子方程式是
的离子方程式是 +4H+=NO↑+3Fe3++2H2O;
+4H+=NO↑+3Fe3++2H2O; + 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O。则气样中NO的含量为
您最近一年使用:0次
名校
解题方法
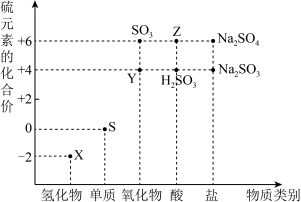
3 . 如图是硫元素的“价—类”二维图:___________ 。
(2) 的浓溶液与铝单质在加热条件下可以发生化学反应生成
的浓溶液与铝单质在加热条件下可以发生化学反应生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ ,可用___________ 法收集 。
。
A.向上排空气 B.向下排空气 C.排饱和食盐水 D.排饱和 溶液
溶液
(3) 和
和 均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。用离子方程式解释原因
均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。用离子方程式解释原因___________ 。
(2)
 的浓溶液与铝单质在加热条件下可以发生化学反应生成
的浓溶液与铝单质在加热条件下可以发生化学反应生成 ,该反应的化学方程式为
,该反应的化学方程式为 。
。A.向上排空气 B.向下排空气 C.排饱和食盐水 D.排饱和
 溶液
溶液(3)
 和
和 均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。用离子方程式解释原因
均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。用离子方程式解释原因
您最近一年使用:0次
名校
解题方法
4 . 硫代硫酸钠 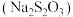 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。
(1)除了以上原料可以制备 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:___________ ;过程主要表现了浓硫酸的哪些性质___________ 。
(3)直到反应完毕,最后发现烧瓶中还有一定量的 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是___________ ,足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是___________ ,___________ 。(填两类不同的化学物质)
A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
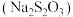 在工业生产、医药制造业中被广泛应用,工业普遍使用
在工业生产、医药制造业中被广泛应用,工业普遍使用 与硫黄
与硫黄 共煮得到。
共煮得到。(1)除了以上原料可以制备
 ,根据“价-类”二维图信息分析,还有合理的是___________。
,根据“价-类”二维图信息分析,还有合理的是___________。A. | B.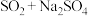 | C. | D.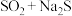 |
(2)如图:向圆底烧瓶中加入浓硫酸并加热,烧瓶中反应的化学方程式:
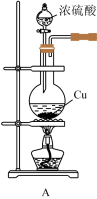
(3)直到反应完毕,最后发现烧瓶中还有一定量的
 和
和 剩余,问题讨论:为什么有一定量的余酸还未能使
剩余,问题讨论:为什么有一定量的余酸还未能使 完全溶解。你认为原因是
完全溶解。你认为原因是A.Fe B.BaCl2溶液 C.Ag D.Na2CO3溶液
您最近一年使用:0次
名校
5 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: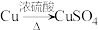 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录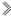 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
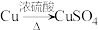 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
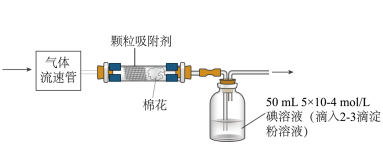
您最近一年使用:0次
2024-04-29更新
|
236次组卷
|
2卷引用:河南省郑州市宇华实验学校2023-2024学年高一下学期4月期中考试化学试题
解题方法
6 . 已知乙醇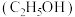 能与
能与 和
和 的混合溶液在一定条件下发生反应:
的混合溶液在一定条件下发生反应: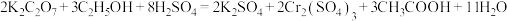 ,
, 和
和 在溶液中分别显橙色和绿色,回答下列问题:
在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应现象是___________ 。
(2)该反应___________ (填“是”或“不是”)氧化还原反应,判断的依据是___________ 。
(3)你认为能否用这一反应来检测司机是否酒后驾车?___________ (填“能”或“不能”),简述其原理:___________ 。
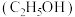 能与
能与 和
和 的混合溶液在一定条件下发生反应:
的混合溶液在一定条件下发生反应: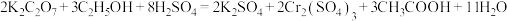 ,
, 和
和 在溶液中分别显橙色和绿色,回答下列问题:
在溶液中分别显橙色和绿色,回答下列问题:(1)该反应现象是
(2)该反应
(3)你认为能否用这一反应来检测司机是否酒后驾车?
您最近一年使用:0次
7 . 分析以下A-D四个涉及H2O2的反应(未配平),填空:
A.
B.
C.
D.
(1)H2O2仅体现氧化性的是_______ ;H2O2仅体现还原性的是_______ ;H2O2既体现氧化性又体现还原性的是_______ ;H2O2既不能体现氧化性又不能体现还原性的是_______ (填代号)。
(2)D反应中1分子还原剂完全反应转移电子为_______ 个。
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: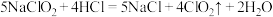 。该反应中氧化剂是
。该反应中氧化剂是_______ ,请用双线桥标明电子转移的方向和数目_______ 。
(4)海水制得的粗盐中常常含有泥沙、Ca2+、Mg2+、 等杂,粗盐提纯的步骤有:①加入过量的BaCl2溶液 ②加入过量的Na2CO3溶液 ③加入过量的NaOH溶液 ④用适量的盐酸调节溶液至中性 ⑤溶解 ⑥过滤 ⑦蒸发,正确的操作顺序是
等杂,粗盐提纯的步骤有:①加入过量的BaCl2溶液 ②加入过量的Na2CO3溶液 ③加入过量的NaOH溶液 ④用适量的盐酸调节溶液至中性 ⑤溶解 ⑥过滤 ⑦蒸发,正确的操作顺序是_______ (填选项字母)
A.⑤⑥①②③④⑥⑦ B.⑤⑥①③②⑥④⑦ C.⑤⑥②③①⑥④⑦ D.⑤⑥③①②⑥④⑦ E.⑤⑥③②①⑥④⑦
A.

B.

C.

D.

(1)H2O2仅体现氧化性的是
(2)D反应中1分子还原剂完全反应转移电子为
(3)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
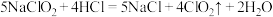 。该反应中氧化剂是
。该反应中氧化剂是(4)海水制得的粗盐中常常含有泥沙、Ca2+、Mg2+、
 等杂,粗盐提纯的步骤有:①加入过量的BaCl2溶液 ②加入过量的Na2CO3溶液 ③加入过量的NaOH溶液 ④用适量的盐酸调节溶液至中性 ⑤溶解 ⑥过滤 ⑦蒸发,正确的操作顺序是
等杂,粗盐提纯的步骤有:①加入过量的BaCl2溶液 ②加入过量的Na2CO3溶液 ③加入过量的NaOH溶液 ④用适量的盐酸调节溶液至中性 ⑤溶解 ⑥过滤 ⑦蒸发,正确的操作顺序是A.⑤⑥①②③④⑥⑦ B.⑤⑥①③②⑥④⑦ C.⑤⑥②③①⑥④⑦ D.⑤⑥③①②⑥④⑦ E.⑤⑥③②①⑥④⑦
您最近一年使用:0次
8 . K2FeO4是常见的水处理剂,其原理如图所示。请回答下列问题:
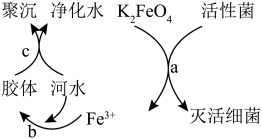
(1)高铁酸钾(K2FeO4)中铁元素的化合价为________ .
(2)过程a中K2FeO4体现________ (填“氧化”或“还原”)性,氧化产物是________ 。
(3)过程b反应的离子方程式为________ ,过程c属于________ (填“物理”或“化学”)变化。
(4)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:________ 。
Fe(OH)3+_______KOH+_______KClO=_______ K2FeO4+_______KCl+_______H2O
(5)根据以上K2FeO4净水原理,相比于Cl2,其优点是________ 。

(1)高铁酸钾(K2FeO4)中铁元素的化合价为
(2)过程a中K2FeO4体现
(3)过程b反应的离子方程式为
(4)碱性条件下用Fe(OH)3和KClO反应制备K2FeO4。配平其反应的化学方程式:
Fe(OH)3+_______KOH+_______KClO=_______ K2FeO4+_______KCl+_______H2O
(5)根据以上K2FeO4净水原理,相比于Cl2,其优点是
您最近一年使用:0次
9 . 近年来,我国储氧纳米碳管研究获重大进展,电弧法合成的碳纳米管常伴有大量物质一碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
(1)此反应的氧化剂是_____ ,氧化产物是_____ ,比较两者氧化性的强弱______ 。
(2)在上述反应中 表现出来的性质是_______(填选项编号)。
表现出来的性质是_______(填选项编号)。
(3)上述反应中若产生气体物质11g,则消耗的还原剂_______ g。

(1)此反应的氧化剂是
(2)在上述反应中
 表现出来的性质是_______(填选项编号)。
表现出来的性质是_______(填选项编号)。| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
您最近一年使用:0次
解题方法
10 . 氧化还原反应是从元素化合价是否有变化的角度对化学反应进行分类的结果。结合你的认识完成下列题目。
(1)煤的气化是煤炭综合利用的重要途径之一,主要反应为:C+H2O CO+H2。氧化剂是
CO+H2。氧化剂是_______ (填化学式),碳元素的化合价_______ (填“升高”或“降低”)。
(2)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为_______ ,被还原的物质是_______ (填化学式,下同),被氧化的元素是_______ 。
(3)已知下列反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O。被还原的HNO3与参加反应的HNO3的个数之比为_______ 。
(4)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_______ (填“氧化性”或“还原性”)。
(5)下列各种微粒中,只具有氧化性的是_______ (填序号,下同),只具有还原性的是_______ 。
①Mg ②Cu ③Cu2+ ④H2O2 ⑤Cl- ⑥Cl2
(6)某危险品仓库中存放的化工原料氰化钠(NaCN,N元素化合价-3)有剧毒,一旦进入城市排水系统,后果不堪设想。当仓库发生火灾爆炸事故时,工作人员一方面封堵氰化钠泄漏渠道,另一方面对已经泄漏的少量氰化钠做无害化处理。下列物质中,可用于处理泄漏的氰化钠的是_______ (填序号)。
①铁粉 ②双氧水 ③臭氧(O3) ④氯化钠
(1)煤的气化是煤炭综合利用的重要途径之一,主要反应为:C+H2O
 CO+H2。氧化剂是
CO+H2。氧化剂是(2)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为
(3)已知下列反应:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O。被还原的HNO3与参加反应的HNO3的个数之比为
(4)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有
(5)下列各种微粒中,只具有氧化性的是
①Mg ②Cu ③Cu2+ ④H2O2 ⑤Cl- ⑥Cl2
(6)某危险品仓库中存放的化工原料氰化钠(NaCN,N元素化合价-3)有剧毒,一旦进入城市排水系统,后果不堪设想。当仓库发生火灾爆炸事故时,工作人员一方面封堵氰化钠泄漏渠道,另一方面对已经泄漏的少量氰化钠做无害化处理。下列物质中,可用于处理泄漏的氰化钠的是
①铁粉 ②双氧水 ③臭氧(O3) ④氯化钠
您最近一年使用:0次



