名校
解题方法
1 . 回答下列问题。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于______ (填“酸性氧化物”、“碱性氧化物”或“两性氧化物”),下列物质均能与它们发生反应的是______ (填字母)。
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应: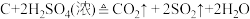 。作还原剂的物质是
。作还原剂的物质是______ ,硫元素的化合价______ (填“升高”或“降低”)。
(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、 、H2O和一种未知离子X
、H2O和一种未知离子X
①已知 在反应中得到电子,则X是
在反应中得到电子,则X是______ 。
②该反应的离子方程式是______ 。
(1)依据物质的性质分析:CaO、Na2O、Fe2O3、CuO均属于
a.水 b.盐酸 c.氢氧化钠溶液
(2)木炭与浓硫酸发生反应:
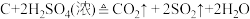 。作还原剂的物质是
。作还原剂的物质是(3)某反应中反应物与生成物的Fe3+、Mn2+、H+、
 、H2O和一种未知离子X
、H2O和一种未知离子X①已知
 在反应中得到电子,则X是
在反应中得到电子,则X是②该反应的离子方程式是
您最近一年使用:0次
2 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素是___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。

(3)反应中每生成1个 ,转移
,转移___________ 个电子。
(4)请配平下列离子方程式:___________ 。
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: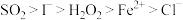 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素是
(2)用“双线桥法”表示反应中电子转移的方向和数目:

(3)反应中每生成1个
 ,转移
,转移(4)请配平下列离子方程式:
___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知
 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: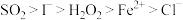 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。A.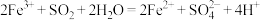 |
B. |
C.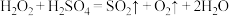 |
D. |
您最近一年使用:0次
名校
解题方法
3 . 完成下列小题
(1) 溶液含中,含
溶液含中,含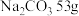 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度_____  。
。
(2)对于反应: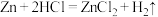 ,现有
,现有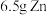 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有_____ 。
(3)对于反应: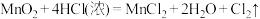 。
。
①用双线桥法表示上述反应电子转移的方向和数目_____ 。
②上述反应中还原剂是_____ ,若该反应有中有 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量_____ g,生成氯在气在STP时体积是_____ L。
③若使用浓盐酸的质量分数0.365、密度 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是_____  。
。
(1)
 溶液含中,含
溶液含中,含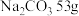 ,则该溶液中
,则该溶液中 的物质的量浓度
的物质的量浓度 。
。(2)对于反应:
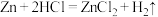 ,现有
,现有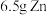 放入
放入 的
的 溶液中充分反应后,溶液中存在的溶质有
溶液中充分反应后,溶液中存在的溶质有(3)对于反应:
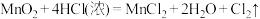 。
。①用双线桥法表示上述反应电子转移的方向和数目
②上述反应中还原剂是
 电子转移,实际参加反应的
电子转移,实际参加反应的 质量
质量③若使用浓盐酸的质量分数0.365、密度
 ,该浓盐酸物质的量浓度是
,该浓盐酸物质的量浓度是 。
。
您最近一年使用:0次
名校
解题方法
4 . 按要求填空:
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+

(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:___________ 。
②反应Ⅱ:___________ 。
(2)NO在总反应中的作用是___________ 。
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:___________ 。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:___________ 。
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是___________ 。
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是___________ 。
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是
您最近一年使用:0次
2023-11-04更新
|
295次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高一上学期11月期中考试化学试题
名校
5 . 回答下列问题:
(1)“春蚕到死丝方尽,蜡炬成灰泪始干”中涉及到蜡烛与 的燃烧反应,反应生成
的燃烧反应,反应生成 和
和 ,该反应一定是______(填序号)。
,该反应一定是______(填序号)。
素材I.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为: 。结合素材回答问题(2)~(4):
。结合素材回答问题(2)~(4):
(2)该反应中 的摩尔质量是
的摩尔质量是______
(3)28g铁粉中含有的Fe原子数是______ 。
(4)若28g铁粉完全反应,析出Cu单质的质量为______ 。
素材II.宋代《洗冤集录》中记载有“银针探毒”,其原理是: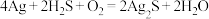 。结合素材回答问题(5)~(6):
。结合素材回答问题(5)~(6):
(5)在相同条件下体积相同的 和
和 两种气体分子数之比为
两种气体分子数之比为______ 。
(6)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的 的体积是
的体积是______ 。
素材III.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为: 。结合素材回答问题(7)~(8):
。结合素材回答问题(7)~(8):
(7)该反应中,化合价升高的元素是______ (填元素符号)。
(8)该反应中,作为氧化剂的物质是______ (填化学式)。
(9)向空气中排放 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
该雨水中氢离子的浓度a=______ 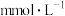 。
。
(1)“春蚕到死丝方尽,蜡炬成灰泪始干”中涉及到蜡烛与
 的燃烧反应,反应生成
的燃烧反应,反应生成 和
和 ,该反应一定是______(填序号)。
,该反应一定是______(填序号)。| A.离子反应 | B.分解反应 | C.氧化还原反应 | D.置换反应 |
素材I.“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:
 。结合素材回答问题(2)~(4):
。结合素材回答问题(2)~(4):(2)该反应中
 的摩尔质量是
的摩尔质量是(3)28g铁粉中含有的Fe原子数是
(4)若28g铁粉完全反应,析出Cu单质的质量为
素材II.宋代《洗冤集录》中记载有“银针探毒”,其原理是:
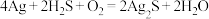 。结合素材回答问题(5)~(6):
。结合素材回答问题(5)~(6):(5)在相同条件下体积相同的
 和
和 两种气体分子数之比为
两种气体分子数之比为(6)在0℃、101kPa条件下,11.2L氧气完全反应,消耗的
 的体积是
的体积是素材III.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为:
 。结合素材回答问题(7)~(8):
。结合素材回答问题(7)~(8):(7)该反应中,化合价升高的元素是
(8)该反应中,作为氧化剂的物质是
(9)向空气中排放
 会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:
会造成酸雨,检测出某地雨水中的离子组成和浓度如下表所示:离子 |
|
|
|
|
|
浓度( | 0.06 | 0.08 | 0.02 | 0.04 | a |
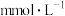 。
。
您最近一年使用:0次
2022-12-13更新
|
198次组卷
|
2卷引用:福建省厦门市第十中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
6 . 氧化还原反应在生产生活中有广泛的应用,中国传统文化中有广泛记载。
(1)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu,该反应中CuSO4的摩尔质量是___________ 。28 g铁粉完全反应,析出Cu单质的物质的量为___________ 。
(2)宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O,在相同条件下体积相同的H2S和O2两种气体原子数之比为___________ ,质量比为___________ 。标准状况下22.4 mL O2中氧原子的物质的量n(O)=___________ mol,当发生上述反应时氧气完全反应,消耗的标准状况下H2S的体积是___________ mL。
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为: ,在此反应中,被还原的元素为
,在此反应中,被还原的元素为___________ (填元素符号),氧化产物是___________ (填化学式),6.4gS参加反应时,产生气体的体积为___________ L(标况下),反应中被S氧化的C的物质的量为___________ mol。
(1)“熬胆矾铁釜,久之亦化为铜”涉及到的化学反应为:CuSO4+Fe=FeSO4+Cu,该反应中CuSO4的摩尔质量是
(2)宋代《洗冤集录》中记载有“银针探毒”,其原理是:4Ag+2H2S+O2=2Ag2S+2H2O,在相同条件下体积相同的H2S和O2两种气体原子数之比为
(3)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为:
 ,在此反应中,被还原的元素为
,在此反应中,被还原的元素为
您最近一年使用:0次
2022-11-14更新
|
295次组卷
|
2卷引用:山东省聊城第一中学2022-2023学年高一上学期11月期中考试化学试题
7 . 在加热条件下,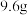 铜丝与
铜丝与 的硝酸恰好完全反应,产生一定量
的硝酸恰好完全反应,产生一定量 和
和 的混合气体(反应过程中溶液体积变化忽略不计)。
的混合气体(反应过程中溶液体积变化忽略不计)。
(1)硝酸铜物质的量浓度为_______  。
。
(2)整个过程中被还原的硝酸物质的量为_______  。
。
(3)混合气体中 的体积为
的体积为_______  。(标准状况下)
。(标准状况下)
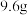 铜丝与
铜丝与 的硝酸恰好完全反应,产生一定量
的硝酸恰好完全反应,产生一定量 和
和 的混合气体(反应过程中溶液体积变化忽略不计)。
的混合气体(反应过程中溶液体积变化忽略不计)。(1)硝酸铜物质的量浓度为
 。
。(2)整个过程中被还原的硝酸物质的量为
 。
。(3)混合气体中
 的体积为
的体积为 。(标准状况下)
。(标准状况下)
您最近一年使用:0次
2022-04-24更新
|
526次组卷
|
2卷引用:浙江省台州市九校联盟2021-2022学年高一下学期期中考试化学试题
解题方法
8 . 单质硫在热的NaOH溶液中发生如下反应:3S+6NaOH 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。
请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=____ 。
(2)NaClO溶液的物质的量浓度为____ mol·L-1 (写出计算过程)。
 2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S
2Na2S+Na2SO3+3H2O。若硫过量,会进一步生成Na2Sx和Na2S2O3:(x-1)S+Na2S Na2Sx,S+Na2SO3
Na2Sx,S+Na2SO3 Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO
Na2S2O3。现有3.84 g硫与含0.06 mol NaOH的热溶液完全反应,生成a mol Na2Sx和b mol Na2S2O3,在混合溶液中加入NaClO碱性溶液300 mL,恰好将硫元素全部转化为SO 。
。请计算:
(1)a mol Na2Sx和b mol Na2S2O3中a∶b=
(2)NaClO溶液的物质的量浓度为
您最近一年使用:0次
名校
9 . 下列四个反应
①2Na+2H2O=2NaOH+H2↑
②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HClO
④C+H2O(g) CO+H2
CO+H2
试从氧化还原的角度,回答下列问题:
(1)水只作还原剂的是___ (填序号),水在反应中既不作氧化剂也不作还原剂__ (填序号)。
(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。反应中氧化剂是__ ,生成1.25mol氧化产物共转移电子__ mol。写出该反应的离子方程式___ 。
①2Na+2H2O=2NaOH+H2↑
②2F2+2H2O=4HF+O2
③Cl2+H2O=HCl+HClO
④C+H2O(g)
 CO+H2
CO+H2试从氧化还原的角度,回答下列问题:
(1)水只作还原剂的是
(2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O。反应中氧化剂是
您最近一年使用:0次
解题方法
10 . 汽车尾气排放出的气体主要有 和
和 ,它们污染环境,可用氨气除去,反应的化学方程式为:
,它们污染环境,可用氨气除去,反应的化学方程式为: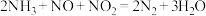 。若反应后得到
。若反应后得到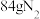 ,理论上需消耗氨气
,理论上需消耗氨气___________ L(标准状况),其中被 氧化的氨气又是
氧化的氨气又是___________  。
。
 和
和 ,它们污染环境,可用氨气除去,反应的化学方程式为:
,它们污染环境,可用氨气除去,反应的化学方程式为: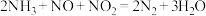 。若反应后得到
。若反应后得到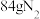 ,理论上需消耗氨气
,理论上需消耗氨气 氧化的氨气又是
氧化的氨气又是 。
。
您最近一年使用:0次






