1 . 在一定条件下,某些物质具有如图所示的转化关系。丙为白色固体,其悬浊液在空气中会迅速变为灰绿色,最终变为红褐色。请回答下列问题: 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
(1)根据分析可知丙为______ (填化学式);甲可能是______ (填标号,下同),乙可能是______ 。
A.稀硝酸 B. 溶液
溶液
C. D.
D. 溶液
溶液
(2)实验室保存 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量______ (填药品名称);可以用______ (填化学式)溶液来检验 溶液中的
溶液中的 是否被氧化。
是否被氧化。
(3)丙的悬浊液在空气中变色的原因为______ (填化学方程式);工业上高炉炼铁可以实现③的转化,所得到的炽热的铁水注入模具之前,模具必须进行充分的干燥处理,原因是______ (填化学方程式)。
(4)绿矾 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为______ ;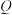 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为______ 。
 表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。
表示一定条件下A能一步转化为B,A……B表示一定条件下A能与B反应。(1)根据分析可知丙为
A.稀硝酸 B.
 溶液
溶液C.
 D.
D. 溶液
溶液(2)实验室保存
 溶液时,为了防止其被氧化,可以往溶液中加入适量
溶液时,为了防止其被氧化,可以往溶液中加入适量 溶液中的
溶液中的 是否被氧化。
是否被氧化。(3)丙的悬浊液在空气中变色的原因为
(4)绿矾
 常用于制备铁触媒催化剂。隔绝空气条件下,
常用于制备铁触媒催化剂。隔绝空气条件下, 绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至
绿矾受热过程中固体的质量随温度变化的曲线如图所示,加热至 时,绿矾发生反应的化学方程式为
时,绿矾发生反应的化学方程式为 点对应的固体是一种金属氧化物,该物质的化学式为
点对应的固体是一种金属氧化物,该物质的化学式为
您最近一年使用:0次
2024-03-27更新
|
130次组卷
|
4卷引用:江西省部分地区2023-2024学年高一下学期3月月考化学试题
2 . 在稀硫酸、二氧化碳、铜片、食盐、石灰水、一氧化碳、纯碱、铁片和木炭粉9种物质间存在图示关系,选择其中适当的物质,使有连线的两种物质发生反应。

请推断它们的化学式:①___________ ;②___________ ;③___________ ;④___________ ;⑤ 。
。

请推断它们的化学式:①
 。
。
您最近一年使用:0次
名校
解题方法
3 . A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)。
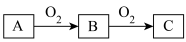
(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是___________ 、___________ ;如果是多种成分,可能是___________ 、___________ 。
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用___________ 。将C长期露置于空气中,最后将变成物质D,D的化学式为___________ 。现有D和 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为___________ 。

(1)若A是一种黑色单质固体,将一定量C缓慢通入NaOH溶液中,充分反应,测得最后溶液的显碱性,此时溶液的溶质如果是单一成分,可能是
(2)若A是一种活泼金属,C是淡黄色固体,试用化学方程式表示该物质C的一个重要应用
 的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
的固体混合物10g,加热至质量不再改变,剩余固体质量为9.38g,D的质量分数为
您最近一年使用:0次
2023-11-30更新
|
106次组卷
|
3卷引用:江西省宜春市丰城市东煌学校2023-2024学年高三上学期12月月考化学试题
名校
解题方法
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
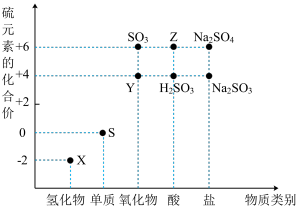
(1)写出化学式:Y___________ ,Z___________ 。
(2)X与Y能否共存___________ (填“能”或“不能”),若不能请写出化学方程式若能请说明理由___________ 。
(3) 与足量Z反应的离子方程式
与足量Z反应的离子方程式___________ 。
(4) 是重要的化工原料。
是重要的化工原料。 中硫元素的化合价为
中硫元素的化合价为___________ ,从氧化还原反应的角度分析,下列制备 的方案理论上可行的是
的方案理论上可行的是___________ (填序号)。
a. b.
b.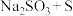 c.
c.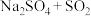 d.
d.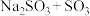
(5)写出Z的浓溶液与木炭发生反应的化学方程式___________ 。
(6)Y与稀硝酸反应,硝酸的还原产物为 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。

(1)写出化学式:Y
(2)X与Y能否共存
(3)
 与足量Z反应的离子方程式
与足量Z反应的离子方程式(4)
 是重要的化工原料。
是重要的化工原料。 中硫元素的化合价为
中硫元素的化合价为 的方案理论上可行的是
的方案理论上可行的是a.
 b.
b.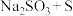 c.
c.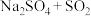 d.
d.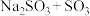
(5)写出Z的浓溶液与木炭发生反应的化学方程式
(6)Y与稀硝酸反应,硝酸的还原产物为
 ,写出反应的化学方程式:
,写出反应的化学方程式:
您最近一年使用:0次
2023-11-15更新
|
268次组卷
|
2卷引用:江西省宜春市丰城拖船中学2023-2024学年高三上学期11月期中化学试题
名校
解题方法
5 . I.A经如图所示的过程可转化为D。已知D为强酸或强碱,请回答下列问题。
A B
B C
C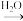 D
D
(1)若常温下C是红棕色的气体,A是碱性气体。则:
①A的化学式是_____ ,C→D的过程中,氧化剂和还原剂的质量之比为_____ 。
②D的稀溶液在常温下可与Cu反应,请写出该反应的离子方程式_____ 。
(2)若A为金属单质,C为淡黄色固体,则C→D的化学反应方程式_____ 。
II.可利用如图装置来证明酸性:H2CO3>H2SiO3。

(3)方法是:在A中加入的试剂是_____ (填编号,下同),B中加入的试剂是_____ ,C中加入的试剂是_____ ;如果在C中看到白色沉淀生成,即可证明酸性:H2CO3>H2SiO3。
供选择的试剂:①稀盐酸 ②稀硫酸 ③碳酸钙 ④Na2SiO3溶液 ⑤碳酸钠
A
 B
B C
C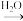 D
D(1)若常温下C是红棕色的气体,A是碱性气体。则:
①A的化学式是
②D的稀溶液在常温下可与Cu反应,请写出该反应的离子方程式
(2)若A为金属单质,C为淡黄色固体,则C→D的化学反应方程式
II.可利用如图装置来证明酸性:H2CO3>H2SiO3。

(3)方法是:在A中加入的试剂是
供选择的试剂:①稀盐酸 ②稀硫酸 ③碳酸钙 ④Na2SiO3溶液 ⑤碳酸钠
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.根据下图转化关系及现象回答问题:
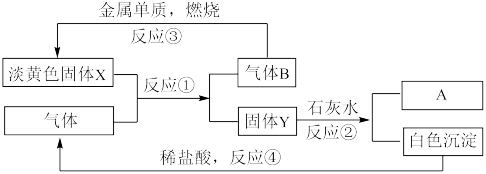
(1)物质A是_______ (填写化学式)
(2)反应①的化学方程式为_______ 。
II.将少量金属钠投入盛有下列溶液的小烧杯中,
(3)既有气体,又有白色沉淀产生的是_______ 。(填序号)
①NaCl溶液 ② 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液 ⑥
溶液 ⑥ 溶液 ⑦
溶液 ⑦ 溶液 ⑧
溶液 ⑧ 溶液
溶液
Ⅲ.我国科学家侯德榜发明的联合制碱法,对世界制碱工业以及我国化工事业的发展做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已省略)。
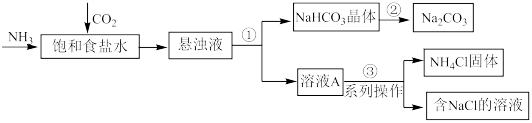
(4)步骤①②③中涉及“过滤”操作的是_______ (填序号)。
(5)向饱和食盐水中通入 和
和 后,生成
后,生成 的化学方程式是
的化学方程式是_______ 。
(6)从步骤①中分离出的 晶体表面含有的杂质可能是
晶体表面含有的杂质可能是_______ (写出杂质的化学式),欲得到纯净的 ,需将其洗涤、干燥。判断
,需将其洗涤、干燥。判断 固体已经纯净的操作方法是:取少量最后一次洗涤液于试管中,
固体已经纯净的操作方法是:取少量最后一次洗涤液于试管中,_______ 。

(1)物质A是
(2)反应①的化学方程式为
II.将少量金属钠投入盛有下列溶液的小烧杯中,
(3)既有气体,又有白色沉淀产生的是
①NaCl溶液 ②
 溶液 ③
溶液 ③ 溶液 ④
溶液 ④ 溶液 ⑤
溶液 ⑤ 溶液 ⑥
溶液 ⑥ 溶液 ⑦
溶液 ⑦ 溶液 ⑧
溶液 ⑧ 溶液
溶液Ⅲ.我国科学家侯德榜发明的联合制碱法,对世界制碱工业以及我国化工事业的发展做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已省略)。

(4)步骤①②③中涉及“过滤”操作的是
(5)向饱和食盐水中通入
 和
和 后,生成
后,生成 的化学方程式是
的化学方程式是(6)从步骤①中分离出的
 晶体表面含有的杂质可能是
晶体表面含有的杂质可能是 ,需将其洗涤、干燥。判断
,需将其洗涤、干燥。判断 固体已经纯净的操作方法是:取少量最后一次洗涤液于试管中,
固体已经纯净的操作方法是:取少量最后一次洗涤液于试管中,
您最近一年使用:0次
2022-11-16更新
|
543次组卷
|
5卷引用:江西省丰城中学2022-2023学年高一上学期第三次段考化学试卷
名校
解题方法
7 . Q溶液中含有如表所示离子中的某5种且浓度均为0.5 (不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
请回答下列问题:
(1)写出一种检验气体R的方法:_______ 。写出产生气体R的离子方程式:_______ 。
(2)由“加入氢溴酸……”、“反应前后阴离子种类不变”推知:Q一定不含_______ (填中文数字)种阴离子。
(3)综合排断,Q一定含离子有_______ (填离子符号)。
(4)一定量Q与氯气缓慢反应,实验结果如下:
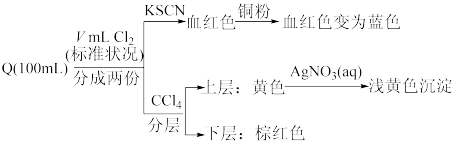
①“血红色溶液”变为蓝色溶液,发生反应的离子方程式为_______ 。
②V的范围为_______ 。
 (不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。
(不考虑水的电离与离子水解)。向Q溶液中加入足量稀氢溴酸,有气体R产生。经分析,反应前后阴离子种类不变。| 阳离子 | 阴离子 |
 、 、 、 、 、 、 、 、 、 、 、 、 、 、 |  、 、 、 、 、 、 、 、 、 、 , , 、 、 |
(1)写出一种检验气体R的方法:
(2)由“加入氢溴酸……”、“反应前后阴离子种类不变”推知:Q一定不含
(3)综合排断,Q一定含离子有
(4)一定量Q与氯气缓慢反应,实验结果如下:

①“血红色溶液”变为蓝色溶液,发生反应的离子方程式为
②V的范围为
您最近一年使用:0次
2022-10-12更新
|
258次组卷
|
2卷引用:江西省稳派名校2023届高三10月统一调研考试化学试题
8 . 短周期主族元素X、Y、Z的原子序数依次增大,X的某种同位素不含中子,Y与Z同族,Z的原子序数是Y的两倍,l、m、p分别为元素X、Y、Z对应的单质,r、s、t、u、v为X、Y、Z形成的二元或三元化合物,这些物质有如下图所示转化关系(反应条件及部分产物已略去),回答下列问题:
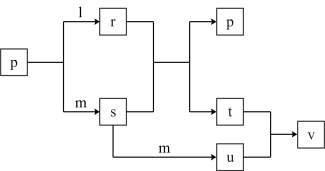
(1)r具有_________ 气味, r与s生成p和t的化学方程式为__________ 。
(2)r______ (填“能”或“不能”)用v的浓溶液干燥,用化学方程式解释其原因_________ 。
(3)用r、空气和KOH溶液可以组成燃料电池,生成Z元素的+4价含氧酸正盐和水。电池工作时负极反应为_________ (用离子方程式表示)。
(4)将10 mol s、5 mol m充入10 L的恒容密闭容器,在500 K条件下生成u气体,平衡时,反应物与生成物的物质的量相等,则s的平衡转化率为_________ ,该反应的平衡常数为___________ 。

(1)r具有
(2)r
(3)用r、空气和KOH溶液可以组成燃料电池,生成Z元素的+4价含氧酸正盐和水。电池工作时负极反应为
(4)将10 mol s、5 mol m充入10 L的恒容密闭容器,在500 K条件下生成u气体,平衡时,反应物与生成物的物质的量相等,则s的平衡转化率为
您最近一年使用:0次
名校
9 . 有一包白色粉末状混合物,可能含有Na2CO3、NaCl、CaCO3、CuSO4、KCl、Na2SO4、MgCl2、KNO3中的某几种,现进行如下实验:
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,向另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有___________ 。
(2)原混合物中肯定有____________ 。
(3)不能确定是否含有____________ 。
①将混合物溶于水,得到无色透明溶液。
②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加上稀硝酸,沉淀不溶解,向另一份中加入NaOH溶液,也产生白色沉淀。
根据上述实验现象回答:
(1)原混合物中肯定没有
(2)原混合物中肯定有
(3)不能确定是否含有
您最近一年使用:0次
2020-09-24更新
|
718次组卷
|
12卷引用:江西省崇义中学2018-2019学年高一上学期第一次月考化学试题
江西省崇义中学2018-2019学年高一上学期第一次月考化学试题江西省赣州市赣县第七中学(赣州市赣县中学西校区)2020-2021学年高一上学期10月月考化学试卷(已下线)2012-2013学年甘肃省天水市一中高一第一次月考化学试卷2014-2015安徽省滁州市六校上高一联考化学试卷河南省濮阳市2016-2017学年高一下学期升级考试(期末)化学试题广东省阳江市阳东广雅学校2017-2018学年高一9月月考化学试题湖南省衡阳县第四中学2019届高三第一次月考(9月)化学试题【全国百强校】山西省实验中学2018-2019学年高一上学期第一次月考化学试题(已下线)第08天 几种常见离子的检验——《2019年暑假作业总动员》高一化学湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题四川省雅安中学2019-2020学年高一10月份月考化学试题高一必修第一册(鲁科2019)第2章第2节 电解质的电离 离子反应
名校
解题方法
10 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
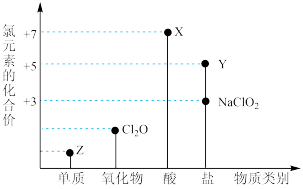
回答下列问题:
(1)X的电离方程式为_________ 。
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=_________ 。
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式_____________ 。
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的___________ 倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为_____________ 。
(6)自来水中的 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平:___ Al+ ____  +
+ _____ =___ 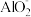 +
+ _____ N2↑ + _______ H2O

回答下列问题:
(1)X的电离方程式为
(2)氯的某种氧化物(ClmOn)中氯、氧元素质量比为71:48,则m:n=
(3) NaClO有较强的氧化性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式
(4)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的
(5)Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为
(6)自来水中的
 对人类健康产生危害。为了降低自来水中
对人类健康产生危害。为了降低自来水中 的浓度,某研究人员提出在碱性条件下用Al粉还原
的浓度,某研究人员提出在碱性条件下用Al粉还原 ,产物是N2。发生的反应可表示如下,请完成方程式的配平:
,产物是N2。发生的反应可表示如下,请完成方程式的配平: +
+ 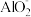 +
+
您最近一年使用:0次
2020-06-15更新
|
101次组卷
|
2卷引用:江西省南昌市八一中学2019-2020学年高一下学期期中考试化学试题



