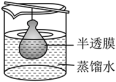
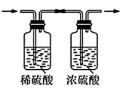
名校
解题方法
1 . 下列实验装置或操作不能够达到实验目的是
|
|
|
|
| A.定容后,溶液的摇匀 | B.淀粉溶胶的净化 | C.除去 中的 中的 并干燥 并干燥 | D.用于 的尾 气吸收 的尾 气吸收 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 向500 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是

 含
含 、
、 、
、 的溶液中缓慢通入
的溶液中缓慢通入 L
L (标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
(标准状况),测得溶液中部分离子的物质的量与V的关系如图所示。下列叙述正确的是
A.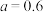 |
B. 时反应为 时反应为 |
C.原溶液中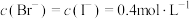 |
D.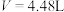 时总反应为 时总反应为 |
您最近一年使用:0次
2024-02-23更新
|
242次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高一下学期开学化学试题
名校
解题方法
3 . 氮及其化合物在工农业生产和生活中有着重要作用。有资料显示过量的氨气和氯气在常温下可合成 (岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1) 的制备:
的制备:

①利用装置B制取实验所需的氯气,写出该反应的化学方程式___________ 。
②装置C的名称为___________ 。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___________ →fe←h←g←___________ (用小写字母和箭头表示,箭头方向与气流方向一致)。
④该实验装置除了D处导管易堵塞外,还存在的不足之处是___________ 。
⑤验证岩脑砂中所含 的操作为
的操作为___________ 。
(2)岩脑砂中元素的定量测定:准确称取 岩脑砂,与足量的氧化铜混合加热,发生的反应为
岩脑砂,与足量的氧化铜混合加热,发生的反应为 ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。

①装置H中盛装的试剂是___________ (填试剂名称)。
②已知装置J中也装有碱石灰,其目的是___________ 。
③若装置I增重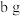 ,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为
,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为 ),则岩脑砂中
),则岩脑砂中
___________ (用含b、V的代数式表示,不必化简)。
 (岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(岩脑砂的主要成分),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:(1)
 的制备:
的制备:
①利用装置B制取实验所需的氯气,写出该反应的化学方程式
②装置C的名称为
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:
④该实验装置除了D处导管易堵塞外,还存在的不足之处是
⑤验证岩脑砂中所含
 的操作为
的操作为(2)岩脑砂中元素的定量测定:准确称取
 岩脑砂,与足量的氧化铜混合加热,发生的反应为
岩脑砂,与足量的氧化铜混合加热,发生的反应为 ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比(夹持装置省略)。
①装置H中盛装的试剂是
②已知装置J中也装有碱石灰,其目的是
③若装置I增重
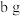 ,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为
,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为 ),则岩脑砂中
),则岩脑砂中
您最近一年使用:0次
名校
4 . 某化学学习小组探究FeSO4与“84消毒液的反应过程,向酸化的FeSO4溶液中逐滴滴入“84消毒液,780s时停止滴入;滴加过程中bc、cd段产生刺激性气味的气体。采用pH传感器测得溶液的pH随时间t(s)的变化曲线如图所示。下列说法错误的是


| A.ab段中有部分Fe2+变成了Fe3+ |
B.bc段的主要反应为 |
| C.cd段产生刺激性气味气体的反应为ClO-+Cl-+2H+=Cl2↑+H2O |
| D.de段pH减小的原因是氯气溶于水反应产生酸性物质 |
您最近一年使用:0次
2023-09-17更新
|
100次组卷
|
3卷引用:重庆市第十一中学校2024届高三第一次测试化学试题
5 .  (黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。

(1)仪器A的名称是___________ 。
(2)安装F中导管时,应选用图2中的___________ 。
(3)A中发生反应生成 和
和 ,其氧化产物和还原产物物质的量之比为
,其氧化产物和还原产物物质的量之比为___________ 。
(4)关闭B的活塞, 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是___________ 。
(5)写出NaOH溶液吸收 的离子方程式
的离子方程式___________ 。
(6)已知在酸性条件下 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(7) 很不稳定,需随用随制,产物用水吸收得到
很不稳定,需随用随制,产物用水吸收得到 溶液。为测定所得溶液中
溶液。为测定所得溶液中 的浓度,进行了下列实验:
的浓度,进行了下列实验:
步骤1:准确量取 溶液10.00mL,稀释成100.00mL试样,量取
溶液10.00mL,稀释成100.00mL试样,量取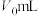 试样加入到锥形瓶中;
试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的 ,加入足量的KI晶体,静置片刻;
,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用 溶液滴定至终点,重复2次,测得消耗
溶液滴定至终点,重复2次,测得消耗 溶液平均值为
溶液平均值为 。(已知
。(已知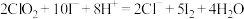 、
、 ),计算原
),计算原 溶液的浓度为
溶液的浓度为___________ g/L(用含字母的代数式表示,计算结果化简)
 (黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
(黄绿色易溶于水的气体)是一种高效、低毒的消毒剂。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收和释放进行了研究。
(1)仪器A的名称是
(2)安装F中导管时,应选用图2中的
(3)A中发生反应生成
 和
和 ,其氧化产物和还原产物物质的量之比为
,其氧化产物和还原产物物质的量之比为(4)关闭B的活塞,
 在D中被稳定剂完全吸收生成
在D中被稳定剂完全吸收生成 ,此时F中溶液的颜色不变,则装置C的作用是
,此时F中溶液的颜色不变,则装置C的作用是(5)写出NaOH溶液吸收
 的离子方程式
的离子方程式(6)已知在酸性条件下
 可发生反应生成NaCl并释放出
可发生反应生成NaCl并释放出 ,该反应的离子方程式为
,该反应的离子方程式为(7)
 很不稳定,需随用随制,产物用水吸收得到
很不稳定,需随用随制,产物用水吸收得到 溶液。为测定所得溶液中
溶液。为测定所得溶液中 的浓度,进行了下列实验:
的浓度,进行了下列实验:步骤1:准确量取
 溶液10.00mL,稀释成100.00mL试样,量取
溶液10.00mL,稀释成100.00mL试样,量取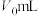 试样加入到锥形瓶中;
试样加入到锥形瓶中;步骤2:用稀硫酸调节试样的
 ,加入足量的KI晶体,静置片刻;
,加入足量的KI晶体,静置片刻;步骤3:加入指示剂,用
 溶液滴定至终点,重复2次,测得消耗
溶液滴定至终点,重复2次,测得消耗 溶液平均值为
溶液平均值为 。(已知
。(已知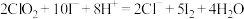 、
、 ),计算原
),计算原 溶液的浓度为
溶液的浓度为
您最近一年使用:0次
名校
6 . 设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.12g金刚石含有的碳碳键数目为2NA |
| B.足量 MnO2与20mL10mol/L浓盐酸共热,充分反应后转移的电子数目为0.1NA |
| C.标准状况下,22.4 L HF中含有的原子数目大于2NA |
D.核反应堆内发生核裂变反应:  n为中子),若体系内中子增加0.004NA,则消耗235U质量为0.47g n为中子),若体系内中子增加0.004NA,则消耗235U质量为0.47g |
您最近一年使用:0次
2023·河北·模拟预测
名校
7 .  (三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知: 在
在 时恰好完全沉淀为
时恰好完全沉淀为 ;②不同温度下
;②不同温度下 在水中的溶解度如图所示。
在水中的溶解度如图所示。

(一) 的制备
的制备
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 ,可用金属钴与氯气反应制备
,可用金属钴与氯气反应制备 。实验中利用如图装置(连接用橡胶管省略)进行制备。
。实验中利用如图装置(连接用橡胶管省略)进行制备。
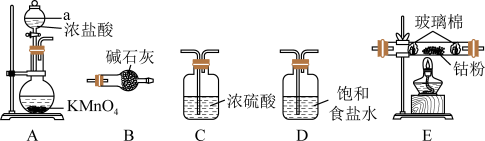
(1)仪器a的名称为_______ 。
(2)用图中的装置组合制备 ,连接顺序为
,连接顺序为_______ 。装置B的作用是_______ 。
(3)装置A中发生反应的离子方程式为_______ 。
(二) 的制备
的制备
步骤如下:
Ⅰ.在100 mL锥形瓶内加入4.5 g研细的 ,
, 和5 mL水,加热溶解后加入0.3 g活性炭作催化剂。
和5 mL水,加热溶解后加入0.3 g活性炭作催化剂。
Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入 溶液。
溶液。
Ⅲ.在60℃下反应一段时间后,经过_______、过滤、洗涤、干燥等操作,得到 晶体。
晶体。
(4)在加入浓氨水前,需在步骤Ⅰ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因_______ 。
(5)步骤Ⅱ中在加入 溶液时,控制温度在10℃以下并缓慢加入的目的是
溶液时,控制温度在10℃以下并缓慢加入的目的是_______ 、_______ 。
(6)制备 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
(7)步骤Ⅲ中的操作名称为_______ 。
 (三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
(三氯化六氨合钴)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:
 在
在 时恰好完全沉淀为
时恰好完全沉淀为 ;②不同温度下
;②不同温度下 在水中的溶解度如图所示。
在水中的溶解度如图所示。
(一)
 的制备
的制备 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 ,可用金属钴与氯气反应制备
,可用金属钴与氯气反应制备 。实验中利用如图装置(连接用橡胶管省略)进行制备。
。实验中利用如图装置(连接用橡胶管省略)进行制备。
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,连接顺序为
,连接顺序为(3)装置A中发生反应的离子方程式为
(二)
 的制备
的制备步骤如下:
Ⅰ.在100 mL锥形瓶内加入4.5 g研细的
 ,
, 和5 mL水,加热溶解后加入0.3 g活性炭作催化剂。
和5 mL水,加热溶解后加入0.3 g活性炭作催化剂。Ⅱ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
 溶液。
溶液。Ⅲ.在60℃下反应一段时间后,经过_______、过滤、洗涤、干燥等操作,得到
 晶体。
晶体。(4)在加入浓氨水前,需在步骤Ⅰ中加入
 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅱ中在加入
 溶液时,控制温度在10℃以下并缓慢加入的目的是
溶液时,控制温度在10℃以下并缓慢加入的目的是(6)制备
 的总反应的化学方程式为
的总反应的化学方程式为(7)步骤Ⅲ中的操作名称为
您最近一年使用:0次
2023-04-21更新
|
731次组卷
|
5卷引用:重庆市七校2023-2024学年高三上学期开学考试化学试题
重庆市七校2023-2024学年高三上学期开学考试化学试题(已下线)2023年普通高中学业水平选择性考试化学押题卷(八)(已下线)化学-2023年高考押题预测卷01(天津卷)(含考试版、全解全析、参考答案、答题卡)天津市耀华中学2023届高三下学期第二次模拟考试化学试题黑龙江省大庆市大庆中学2023届高三下学期模拟预测理综化学试题
名校
解题方法
8 . 钴及其化合物在化工生产中有重要的用途。三氯化六氨合钴(Ⅲ)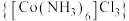 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:
Ⅰ. 的制备
的制备
 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
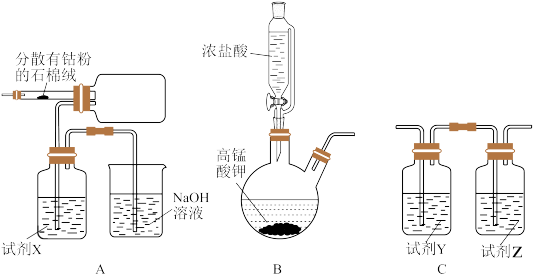
(1)装置的连接顺序为_______ (填字母),B装置用于制备氧气,其反应的化学方程式为_______ ,A装置中试剂X的名称为_______ 。
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是_______ 。
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为: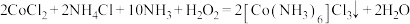 。
。

已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过 的原因是
的原因是_______ 。
(4)下列说法不正确的是_______(填标号)。
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是_______ ,从而获取晶胞形状和大小、分子或原子在微观空间的有序排列。已知 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到_______ 种产物。
(6)利用 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用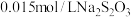 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为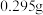 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为_______ %。
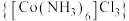 是黄色或橙黄色晶体,实验室以
是黄色或橙黄色晶体,实验室以 为原料经催化制备
为原料经催化制备 ,步骤如下:
,步骤如下:Ⅰ.
 的制备
的制备 (易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净
(易潮解)可以通过钴和氯气反应制得,实验室用下图实验装置制备纯净 。
。
(1)装置的连接顺序为
(2)组装好仪器进行实验时,要先加入浓盐酸,使B装置中开始生成氯气,待A装置内充满黄绿色气体,再加热A装置中的钴粉,目的是
Ⅱ.三氯化六氨合钴(Ⅲ)的制备。其原理为:
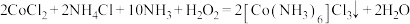 。
。
已知:三氯化六氨合钴不溶于乙醇,常温水中溶解度较小。
(3)水浴温度不超过
 的原因是
的原因是(4)下列说法不正确的是_______(填标号)。
A. 除作为反应物外,还有调节溶液的 除作为反应物外,还有调节溶液的 的作用 的作用 |
| B.活性炭是脱色剂,固体2是活性炭 |
C.加入浓盐酸,析出产品的反应方程式为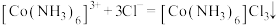 |
| D.可用乙醇水溶液洗涤产品 |
Ⅲ.晶体结构测定与钴含量分析。
(5)测定晶体结构最常见的仪器是
 具有正八面体的空间结构,
具有正八面体的空间结构, 中的2个
中的2个 被2个
被2个 取代,能得到
取代,能得到(6)利用
 将
将 氧化成
氧化成 ,
, 被还原后的产物为
被还原后的产物为 。然后用
。然后用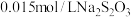 标准溶液滴定生成的
标准溶液滴定生成的 (已知:
(已知: )。若称取样品的质量为
)。若称取样品的质量为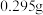 ,滴定
,滴定 时,达到终点消耗
时,达到终点消耗 标准溶液的平均体积为
标准溶液的平均体积为 。该样品中钴元素的质量分数为
。该样品中钴元素的质量分数为
您最近一年使用:0次
名校
9 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为_______ 。
②除杂装置B中盛装的试剂为_______ 。
③C中有多个反应发生,其中生成高铁酸钾的的反应方程式,并用单线桥表示其电子转移情况_____ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
Ⅰ.由方案Ⅰ中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能有_______ 产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是_______ 。
②根据K2FeO4的制备实验得出:氧化性Cl2_____  (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
③资料表明,酸性溶液中的氧化性 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置,其中装有浓盐酸的仪器名称为
②除杂装置B中盛装的试剂为
③C中有多个反应发生,其中生成高铁酸钾的的反应方程式,并用单线桥表示其电子转移情况
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生。 |
Ⅰ.由方案Ⅰ中溶液变红可知a中含有
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性
 >
> ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性 >
> 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
您最近一年使用:0次
名校
解题方法
10 . 某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中装置A、F分别为氨气和氯气的发生装置,装置C为纯净、干燥的氯气与氨气发生反应的装置。回答下列问题:
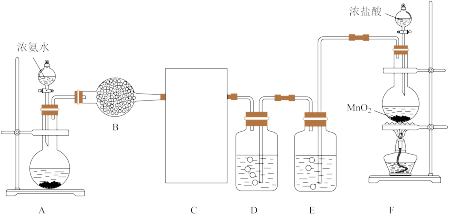
(1)装置F中发生反应的化学方程式是_______ 。
(2)盛有浓氨水的仪器名称是_______ ,E中的试剂是_______ 。
(3)C中的装置应选用图中的_______ (填甲或乙)。

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式_______ 。
(5)兴趣小组查资料得知,在催化剂作用下,NH3与NO2能反应生成无污染的产物。另外收集了少量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子 夹好)
夹好)
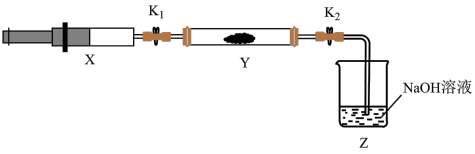
。

(1)装置F中发生反应的化学方程式是
(2)盛有浓氨水的仪器名称是
(3)C中的装置应选用图中的

(4)装置C中集气瓶中有大量白烟产生,另一产物是空气主要成分,写出发生反应的化学方程式
(5)兴趣小组查资料得知,在催化剂作用下,NH3与NO2能反应生成无污染的产物。另外收集了少量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子
 夹好)
夹好)
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢入Y管中 | Y管中红棕色气体慢慢变浅 | 反应的化学方程式① |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ② | ③ |
您最近一年使用:0次
2022-09-09更新
|
128次组卷
|
2卷引用:重庆市万州第二高级中学2022-2023学年高二上学期开学考试化学试题