名校
解题方法
1 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如下图所示:
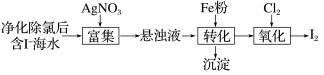
①加入Fe粉进行转化反应是一个置换反应,该反应的化学方程式为___________ ,生成的沉淀与硝酸反应,生成___________ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的的离子方程式为___________ ;当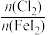 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是___________ 。
(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少为___________ mol。I2在KI溶液中可发生反应:I2+I- 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是___________ 。
(1)I2的一种制备方法如下图所示:

①加入Fe粉进行转化反应是一个置换反应,该反应的化学方程式为
②通入Cl2的过程中,若氧化产物只有一种,反应的的离子方程式为
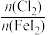 >1.5后,单质碘的收率会降低,原因是
>1.5后,单质碘的收率会降低,原因是(2)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少为
 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
您最近一年使用:0次
2 . NaCl是一种化工原料,可以制备多种物质,如下图所示。其中,常温常压下X为黄绿色的气态单质。根据图示的转化关系填空:

(1)氯化钠溶液通电后,发生反应的化学方程式为:___________ ,纯净的氢气在X中燃烧的现象为:___________ 。
(2)X通入NaOH溶液中可得84消毒液,请写出该反应的离子方程式___________ ;曾有报道,因“洁厕灵”(主要成分是盐酸)与“84”消毒液混合使用而发生中毒事件,请结合离子方程式分析其原因:___________ 。
(3)工业上通过X与Z反应获取漂白粉,漂白粉的有效成分是___________ ,若长期露置在空气中,其漂白作用会减弱甚至失效,其原因是___________ (用化学方程式表示)。

(1)氯化钠溶液通电后,发生反应的化学方程式为:
(2)X通入NaOH溶液中可得84消毒液,请写出该反应的离子方程式
(3)工业上通过X与Z反应获取漂白粉,漂白粉的有效成分是
您最近一年使用:0次
2023-12-14更新
|
77次组卷
|
2卷引用:海南省海口市海南中学2023-2024学年高一上学期11月期中考试化学试题
3 . Ⅰ.一些物质的转化关系如图所示。 已知反应①为常温下的反应,A、C、D 中均含有氯元素,且 A 黄绿色气体,E 在常温下为无色无味的液体,F 是淡黄色固体,G 为常见的无色气体。请回答下列问题。

(1)G、A 的化学式分别为_________ 、_________ 。
(2)写出反应①的离子方程式:_________ 。
(3)写出反应②的化学方程式:_________ 。
Ⅱ.海水晒制粗盐的主要成分为 NaCl,还含有少量的 MgCl2、CaCl2、MgSO4泥沙等杂质。由粗盐获取较纯净精盐的工艺流程如图所示,请回答下列问题

(4)为除去 MgCl2、CaCl2、MgSO4,可溶性杂质,操作I中依次加入的物质(过量) 和顺序合理的是_________ (填字母序号)。
a. NaOH、BaCl2、Na2CO3 b. Ba(NO3)2、Na2CO3、NaOH
c.Na2CO3、BaCl2、NaOH d. BaCl2、NaOH、Na2CO3
(5)为获取较纯净精盐,操作Ⅱ的具体方法是_________ 。

(1)G、A 的化学式分别为
(2)写出反应①的离子方程式:
(3)写出反应②的化学方程式:
Ⅱ.海水晒制粗盐的主要成分为 NaCl,还含有少量的 MgCl2、CaCl2、MgSO4泥沙等杂质。由粗盐获取较纯净精盐的工艺流程如图所示,请回答下列问题

(4)为除去 MgCl2、CaCl2、MgSO4,可溶性杂质,操作I中依次加入的物质(过量) 和顺序合理的是
a. NaOH、BaCl2、Na2CO3 b. Ba(NO3)2、Na2CO3、NaOH
c.Na2CO3、BaCl2、NaOH d. BaCl2、NaOH、Na2CO3
(5)为获取较纯净精盐,操作Ⅱ的具体方法是
您最近一年使用:0次
4 . 钛白粉( )广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉(
)广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉( )和金红石粉(
)和金红石粉( )为原料制备高纯度
)为原料制备高纯度 的流程如图所示:
的流程如图所示:

已知: 遇水极易水解。
遇水极易水解。
(1)在实验室进行操作A,装固体的仪器是___________ (填“坩埚”或“蒸发皿”)。
(2)写出钛铁矿与焦炭、氯气在高温下反应的化学方程式:___________ 。
(3)测定样品中 的纯度。取2.000g
的纯度。取2.000g 样品,在酸性条件下充分溶解,加入适量铝粉将
样品,在酸性条件下充分溶解,加入适量铝粉将 还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
 标准溶液滴定,将
标准溶液滴定,将 转化成
转化成 ,消耗23.00mL标准溶液,杂质在整个过程中不反应。
,消耗23.00mL标准溶液,杂质在整个过程中不反应。
①该样品中 的质量分数为
的质量分数为___________ 。
②若开始时俯视滴定管读数,滴定终点时仰视滴定管读数,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
(4)通过直接氯化法, 能用于制备
能用于制备 粗产品,其制备装置如图所示。
粗产品,其制备装置如图所示。

①若用 和浓盐酸制备氯气,写出装置A中反应的离子方程式:
和浓盐酸制备氯气,写出装置A中反应的离子方程式:___________ 。
②装置B中试剂的名称是___________ 。
③从环境保护角度考虑,本实验不足之处是___________ 。
 )广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉(
)广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉( )和金红石粉(
)和金红石粉( )为原料制备高纯度
)为原料制备高纯度 的流程如图所示:
的流程如图所示:
已知:
 遇水极易水解。
遇水极易水解。(1)在实验室进行操作A,装固体的仪器是
(2)写出钛铁矿与焦炭、氯气在高温下反应的化学方程式:
(3)测定样品中
 的纯度。取2.000g
的纯度。取2.000g 样品,在酸性条件下充分溶解,加入适量铝粉将
样品,在酸性条件下充分溶解,加入适量铝粉将 还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
 标准溶液滴定,将
标准溶液滴定,将 转化成
转化成 ,消耗23.00mL标准溶液,杂质在整个过程中不反应。
,消耗23.00mL标准溶液,杂质在整个过程中不反应。①该样品中
 的质量分数为
的质量分数为②若开始时俯视滴定管读数,滴定终点时仰视滴定管读数,测得结果会
(4)通过直接氯化法,
 能用于制备
能用于制备 粗产品,其制备装置如图所示。
粗产品,其制备装置如图所示。
①若用
 和浓盐酸制备氯气,写出装置A中反应的离子方程式:
和浓盐酸制备氯气,写出装置A中反应的离子方程式:②装置B中试剂的名称是
③从环境保护角度考虑,本实验不足之处是
您最近一年使用:0次



