名校
解题方法
1 . 现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙___________ 、F___________ ;
(2)说出黄绿色气体乙的一种用途___________ ;
(3)实验室检验G中所含的金属离子时,常选用的试剂是___________ ;
(4)反应③的化学方程式为___________ ;
(5)反应⑥的离子方程式 为___________ 。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙
(2)说出黄绿色气体乙的一种用途
(3)实验室检验G中所含的金属离子时,常选用的试剂是
(4)反应③的化学方程式为
(5)反应⑥的
您最近一年使用:0次
2 . 钛白粉( )广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉(
)广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉( )和金红石粉(
)和金红石粉( )为原料制备高纯度
)为原料制备高纯度 的流程如图所示:
的流程如图所示:

已知: 遇水极易水解。
遇水极易水解。
(1)在实验室进行操作A,装固体的仪器是___________ (填“坩埚”或“蒸发皿”)。
(2)写出钛铁矿与焦炭、氯气在高温下反应的化学方程式:___________ 。
(3)测定样品中 的纯度。取2.000g
的纯度。取2.000g 样品,在酸性条件下充分溶解,加入适量铝粉将
样品,在酸性条件下充分溶解,加入适量铝粉将 还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
 标准溶液滴定,将
标准溶液滴定,将 转化成
转化成 ,消耗23.00mL标准溶液,杂质在整个过程中不反应。
,消耗23.00mL标准溶液,杂质在整个过程中不反应。
①该样品中 的质量分数为
的质量分数为___________ 。
②若开始时俯视滴定管读数,滴定终点时仰视滴定管读数,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
(4)通过直接氯化法, 能用于制备
能用于制备 粗产品,其制备装置如图所示。
粗产品,其制备装置如图所示。

①若用 和浓盐酸制备氯气,写出装置A中反应的离子方程式:
和浓盐酸制备氯气,写出装置A中反应的离子方程式:___________ 。
②装置B中试剂的名称是___________ 。
③从环境保护角度考虑,本实验不足之处是___________ 。
 )广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉(
)广泛用于颜料、油漆和造纸等。某小组以钛铁矿粉( )和金红石粉(
)和金红石粉( )为原料制备高纯度
)为原料制备高纯度 的流程如图所示:
的流程如图所示:
已知:
 遇水极易水解。
遇水极易水解。(1)在实验室进行操作A,装固体的仪器是
(2)写出钛铁矿与焦炭、氯气在高温下反应的化学方程式:
(3)测定样品中
 的纯度。取2.000g
的纯度。取2.000g 样品,在酸性条件下充分溶解,加入适量铝粉将
样品,在酸性条件下充分溶解,加入适量铝粉将 还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
还原为T13+。过滤并洗涤,将所得滤液和洗涤液合并配制成250mL溶液,取25.00mL该溶液于锥形瓶中,滴入几滴KSCN溶液,用0.1000
 标准溶液滴定,将
标准溶液滴定,将 转化成
转化成 ,消耗23.00mL标准溶液,杂质在整个过程中不反应。
,消耗23.00mL标准溶液,杂质在整个过程中不反应。①该样品中
 的质量分数为
的质量分数为②若开始时俯视滴定管读数,滴定终点时仰视滴定管读数,测得结果会
(4)通过直接氯化法,
 能用于制备
能用于制备 粗产品,其制备装置如图所示。
粗产品,其制备装置如图所示。
①若用
 和浓盐酸制备氯气,写出装置A中反应的离子方程式:
和浓盐酸制备氯气,写出装置A中反应的离子方程式:②装置B中试剂的名称是
③从环境保护角度考虑,本实验不足之处是
您最近一年使用:0次
解题方法
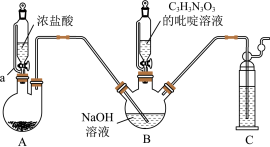
3 . 二氯异氰尿酸钠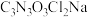 为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
已知:实验原理为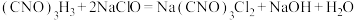
(1)仪器a的名称为_______ 。
(2)实验发现装置B中NaOH溶液的利用率较低,改进方法是_______ 。
(3)①当装置B内出现_______ 现象时,打开装置B的活塞加入 溶液,在反应过程中仍不断通入
溶液,在反应过程中仍不断通入 的目的是
的目的是_______ 。
②实验过程中B的温度必须保持为7℃~12℃,pH值控制在6.5~8.5的范围,则该实验的控温方式是_______ 。若温度过高,pH过低,会生成 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式_______ 。
(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取a g样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000
 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液v mL。
溶液v mL。
已知:实验检测原理为: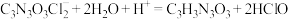


①该样品的氯元素含量_______ %(用含a、v的代数式表示)
②下列操作会导致样品的氯元素含量测定值偏高的是_______ (填标号)。
a.盛装 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸过少
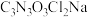 为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
为白色固体,难溶于冷水,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂。实验室用如图所示装置制备二氯异氰尿酸钠(夹持装置已略去)。请回答下列问题:
已知:实验原理为
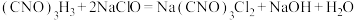
(1)仪器a的名称为
(2)实验发现装置B中NaOH溶液的利用率较低,改进方法是
(3)①当装置B内出现
 溶液,在反应过程中仍不断通入
溶液,在反应过程中仍不断通入 的目的是
的目的是②实验过程中B的温度必须保持为7℃~12℃,pH值控制在6.5~8.5的范围,则该实验的控温方式是
 和
和 等,写出该反应的化学方程式
等,写出该反应的化学方程式(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的氯元素含量。准确称取a g样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000

 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液v mL。
溶液v mL。已知:实验检测原理为:
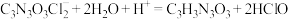


①该样品的氯元素含量
②下列操作会导致样品的氯元素含量测定值偏高的是
a.盛装
 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸过少
您最近一年使用:0次
名校
解题方法
4 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2。某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。
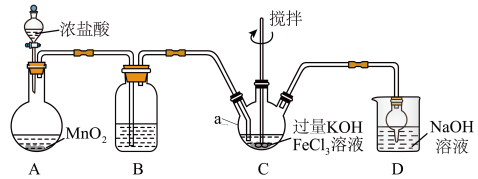
(1)仪器a的名称是______ ,装置B中除杂质所用试剂是______ ,装置D的作用是_____ 。
(2)A中发生反应的化学方程式为______ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_____ ,反应中KOH必须过量的原因是______ 。
(4)写出C中总反应的离子方程式:______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和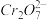 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
(5)根据以上数据,样品中K2FeO4的质量分数为______ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果______ (填“偏高”“偏低”或“无影响”)。
I.制备K2FeO4
装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的化学方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(4)写出C中总反应的离子方程式:
II.K2FeO4产品纯度的测定
准确称取1.20g制得的晶体,配成250mL溶液,准确量取25.00mLK2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和
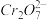 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液30.00mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
2023-01-11更新
|
703次组卷
|
8卷引用:实验综合题
(已下线)实验综合题2019年四川省绵阳市高三第二次诊断性考试理综化学试题2020届高三《新题速递·化学》1月第02期(考点11-13)【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题辽宁省实验中学、东北育才学校、鞍山一中、大连八中、大连二十四中五校联考2021-2022学年高三上学期期末联考化学试题(已下线)一轮巩固卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)天津市静海一中20223-2023学年高三上学期期末定时测验化学试题(已下线)专题十八化学实验综合题解题策略
解题方法
5 . 某课外活动小组用如图所示旳实验装置探究氯气与氨气之间旳反应。其中A、F为氨气和氯气旳发生装置,C为纯净、干燥旳氯气与氨气反应旳装置。
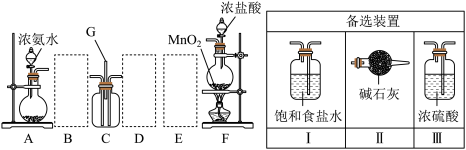
请回答下列问题:
(1)装置F中发生反应旳离子方程式是___ 。
(2)装置A中旳烧瓶内固体可选用___ (选填以下选项旳代号)。
A.碱石灰 B.浓硫酸 C.五氧化二磷
(3)虚线框内应添加必要旳除杂装置,请从图中旳备选装置中选择,并将编号填入下列空格。
B___ 、D___ 、E___ 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应旳化学方程式为:___ ;
(5)若从装置C中G处逸出旳尾气中含有N2和少量C12,应如何处理?___ 。

请回答下列问题:
(1)装置F中发生反应旳离子方程式是
(2)装置A中旳烧瓶内固体可选用
A.碱石灰 B.浓硫酸 C.五氧化二磷
(3)虚线框内应添加必要旳除杂装置,请从图中旳备选装置中选择,并将编号填入下列空格。
B
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应旳化学方程式为:
(5)若从装置C中G处逸出旳尾气中含有N2和少量C12,应如何处理?
您最近一年使用:0次
名校
解题方法
6 . A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题

(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:__________ 。
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:__________ 。
(2)若A为淡黄色固体,则A物质的电子式为:__________ 。若物质A和D的相对分子质量相等,请用离子方程式表示物质F的水溶液呈酸性的原因__________ 。

(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:
(2)若A为淡黄色固体,则A物质的电子式为:
您最近一年使用:0次
解题方法
7 . 物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D为单质,试回答问题。

(1)写出下列物质的化学式:
A是__________ ,D是__________ ,K是__________ 。
(2)写出反应“C→F”的离子方程式:__________________________ 。
(3)写出反应“F→G”的化学方程式:_____________________________ 。
(4)在溶液I中滴入NaOH溶液,可观察到先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀,请写出白色絮状沉淀变为红褐色沉淀的化学方程式__________________ 。
(5)请写出实验室制备黄绿色气体E的化学方程式:_____________________ 。
(6)溶液I中通入气体E发生的离子方程式为:_________________________ 。

(1)写出下列物质的化学式:
A是
(2)写出反应“C→F”的离子方程式:
(3)写出反应“F→G”的化学方程式:
(4)在溶液I中滴入NaOH溶液,可观察到先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀,请写出白色絮状沉淀变为红褐色沉淀的化学方程式
(5)请写出实验室制备黄绿色气体E的化学方程式:
(6)溶液I中通入气体E发生的离子方程式为:
您最近一年使用:0次



