解题方法
1 . 氯及其化合物是重要的化工原料。回答问题:
(1)在新制氯水中加入紫色石蕊试液的现象是___________ 。
(2)现设计实验由大理石、水、氯气来制取漂白粉:
大理石 漂白粉溶液
漂白粉溶液 漂白粉
漂白粉
①制取漂白粉溶液的过程中,发生氧化还原反应的离子方程式为___________ 。
②将漂白粉加入含 的废水(密度为
的废水(密度为 )中,发生反应:
)中,发生反应: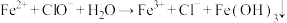 。理论上处理10吨含
。理论上处理10吨含 浓度为
浓度为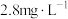 的废水(不考虑其他物质与漂白粉的反应),所需含
的废水(不考虑其他物质与漂白粉的反应),所需含 质量分数为
质量分数为 的漂白粉的质量为
的漂白粉的质量为___________ g。
(3)几种含氯离子的相对能量如下表所示:
①在上述五种离子中,最稳定的离子是___________ (填离子符号)。
②反应 的
的
___________  。
。
③写出 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:______ 。
(4)以 为原料,用
为原料,用 氧化制取
氧化制取 ,可提高效益减少污染。反应如下:
,可提高效益减少污染。反应如下:

上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使 转化率接近
转化率接近 ,其基本原理如图所示。过程
,其基本原理如图所示。过程 的反应为
的反应为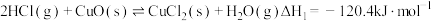 ,过程II反应的热化学方程式为
,过程II反应的热化学方程式为___________ 。

(1)在新制氯水中加入紫色石蕊试液的现象是
(2)现设计实验由大理石、水、氯气来制取漂白粉:
大理石
 漂白粉溶液
漂白粉溶液 漂白粉
漂白粉①制取漂白粉溶液的过程中,发生氧化还原反应的离子方程式为
②将漂白粉加入含
 的废水(密度为
的废水(密度为 )中,发生反应:
)中,发生反应: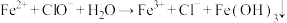 。理论上处理10吨含
。理论上处理10吨含 浓度为
浓度为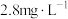 的废水(不考虑其他物质与漂白粉的反应),所需含
的废水(不考虑其他物质与漂白粉的反应),所需含 质量分数为
质量分数为 的漂白粉的质量为
的漂白粉的质量为(3)几种含氯离子的相对能量如下表所示:
| 离子 | Cl—(aq) | ClO——(aq) |  (aq) (aq) |  (aq) (aq) |  (aq) (aq) |
| 相对能量/(kJ·mol-1) | 0 | 60 | 101 | 63 | 38 |
①在上述五种离子中,最稳定的离子是
②反应
 的
的
 。
。③写出
 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:(4)以
 为原料,用
为原料,用 氧化制取
氧化制取 ,可提高效益减少污染。反应如下:
,可提高效益减少污染。反应如下:
上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使
 转化率接近
转化率接近 ,其基本原理如图所示。过程
,其基本原理如图所示。过程 的反应为
的反应为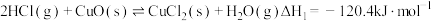 ,过程II反应的热化学方程式为
,过程II反应的热化学方程式为
您最近一年使用:0次
名校
2 . Ⅰ.完成下列问题
(1)市售浓盐酸的密度为1.180 g/mL,物质的量浓度为 11.64 mol/L,此浓盐酸的质量分数为_______ ;若将100g此盐酸加水稀释至5.82mol/L,则加入水的质量_______ 100g。(填“大于”、“等于”或“小于”);
Ⅱ.某同学在实验室中用此浓盐酸与MnO2为原料制取纯净干燥的Cl2,装置如下图:
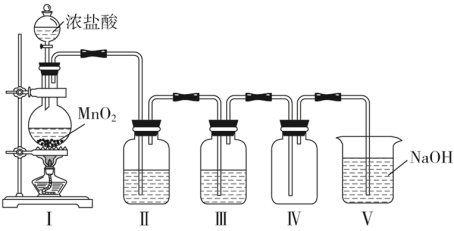
(2)装置Ⅰ中盛装浓盐酸的仪器名称为_______ ;圆底烧瓶中发生反应的离子方程式为_______ ;此反应中HCl体现出性质有_______ 和 _______ 。若生成标准状况下22.4L Cl2,被氧化的HCl分子数是_______ 。
(3)Ⅱ和Ⅲ中盛装的试剂分别是_______ 和_______ 。
(4)氯气的水溶液为氯水,Cl2与H2O反应的离子方程式为_______ ;
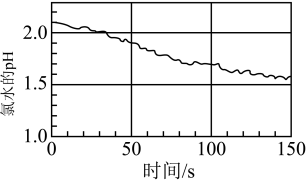
(5)如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是_______
(6)装置Ⅴ中NaOH溶液的作用是吸收尾气,其中发生反应的化学方程式为 _______ 。
(1)市售浓盐酸的密度为1.180 g/mL,物质的量浓度为 11.64 mol/L,此浓盐酸的质量分数为
Ⅱ.某同学在实验室中用此浓盐酸与MnO2为原料制取纯净干燥的Cl2,装置如下图:

(2)装置Ⅰ中盛装浓盐酸的仪器名称为
(3)Ⅱ和Ⅲ中盛装的试剂分别是
(4)氯气的水溶液为氯水,Cl2与H2O反应的离子方程式为
(5)如图是数字化实验得到的光照过程中氯水的pH变化情况。对此,下列有关说法正确的是_______

| A.光照使氯水中的次氯酸分解为盐酸,溶液的酸性增强 |
| B.随着对氯水光照时间的延长,氯水的漂白性将增强 |
| C.随着对氯水光照时间的延长,溶液中Cl-的浓度不断减小 |
| D.随着对氯水光照时间的延长,氯水颜色逐渐变浅 |
您最近一年使用:0次
名校
解题方法
3 . 某品牌洁厕液的主要信息如图所示,下列说法正确的是
| 产品信息 产品名称:洁厕液 产品含量:500mL 产品成分:稀盐酸、香精 适用范围:便池、马桶和其他陶瓷表面 HCl含量:36.5 g/瓶 |
| A.该洁厕液能使紫色石蕊试液先变蓝后褪色 |
| B.该洁厕液易腐蚀大理石地砖 |
| C.HCl具有强氧化性,因此该洁厕液可用于杀菌消毒 |
| D.该洁厕液中HCl的物质的量浓度为1mol⋅L﹣1 |
您最近一年使用:0次
4 . 海洋蕴藏着中极为丰富的化学资源,如海水中就有80多种元素,所含的盐大部分是氯化钠。十九世纪末工业上开始通过电解饱和食盐水的方法制备氯气、氨气和烧碱,并以它们为原料生产一系列含氯、含钠产品(氯碱工业),请回答下列问题:
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
(2)电解饱和食盐水时,与电源正极相连的电极叫阳极,阳极产物是氯气,可以用______ 检验,现象为______ ,写出检验氯气的离子方程式_____________________
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
(4)新制氧水呈浅黄绿色,是因为氯水中存在______(单选)
(5)有两组学生根据不同的反应原理在实验室制取氯气。

①请按要求填表。
②有同学建议第一组使用图所示装置作为氯气的发生装置,请谈谈你的看法______ 。
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。
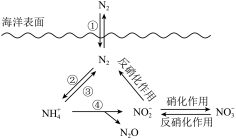
(6)海洋中的氮循环属于固氮作用的一步是______ (填图中的数字序号)。
(7)下列关于海洋氮循环的说法正确的是______(双选)。
(8)有氧时,在硝化细菌作用下, 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。_______ 。

(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是______ ,在最佳反应温度时, 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是____ 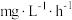 。
。
(1)天原化工厂是我国最早的氯碱企业,其创始人是______(单选)
| A.侯德榜 | B.吴蕴初 | C.荣毅仁 | D.戴安邦 |
(3)工业上用氯气与消石灰制成漂白粉,漂白粉的有效成分为______(单选)
A. | B. | C. | D. |
A. | B. | C. | D. |

①请按要求填表。
实验组 | 实验原理 | 发生装置(填编号) |
第一组 |  | |
第二组 | 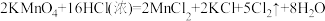 |

氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。

(6)海洋中的氮循环属于固氮作用的一步是
(7)下列关于海洋氮循环的说法正确的是______(双选)。
| A.海洋中存在游离态的氮 |
| B.海洋中的氮循环起始于氮的氧化 |
C.向海洋排放含 的废水会影响海洋中 的废水会影响海洋中 的含量 的含量 |
| D.海洋中的反硝化作用一定有氧气的参与 |
 可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
可实现过程④的转化,方程式如下,请标出该反应的电子转移的方向与数目。
(9)有人研究了温度对海洋硝化细菌去除氯氮效果的影响.下表为对
 人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是
人工海水样本的监测数据.硝化细菌去除氨氮的最佳反应温度是 内去除氨氮反应的平均速率是
内去除氨氮反应的平均速率是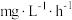 。
。温度/ | 样本氨氮含量/ | 处理 | 处理 |
氨氮含量/ | 氨氮含量/ | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
您最近一年使用:0次
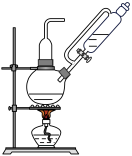
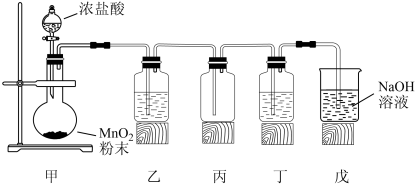
5 . 1774年,舍勒在研究软锰矿(主要成分MnO2)时,将它与浓盐酸混合加热,产生了一种黄绿色气体。舍勒的方法沿用至今,实验室用如下装置制取氯气并进行氯气性质探究。
完成下列填空。
(1)甲为发生装置,该处还缺少的玻璃仪器是_______ 。盛放浓盐酸的仪器名称为_______ 。
(2)乙为除杂装置,盛有_______ (填写下列字母编号),目的是为了_______ 。
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液 e.四氯化碳
(3)检验丙装置中氯气是否已集满的操作是_______ 。
(4)丁装置中盛有紫色石蕊试液,实验中可观察到溶液颜色发生了如下变化。请完成下表中的三处空白。
(5)戊装置的作用是_______ ,该处的化学反应方程式为_______ 。
(6)实验结束,测得戊装置中溶液质量为200g,NaOH溶液的质量分数由30%减小到1%,则吸收的氯气质量是_______ g(保留一位小数)。

完成下列填空。
(1)甲为发生装置,该处还缺少的玻璃仪器是
(2)乙为除杂装置,盛有
a.碱石灰 b.饱和食盐水 c.浓硫酸 d.饱和碳酸氢钠溶液 e.四氯化碳
(3)检验丙装置中氯气是否已集满的操作是
(4)丁装置中盛有紫色石蕊试液,实验中可观察到溶液颜色发生了如下变化。请完成下表中的三处空白。
| 实验现象 | 原因 |
| 最初溶液从紫色逐渐变为 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变为 | / |
(6)实验结束,测得戊装置中溶液质量为200g,NaOH溶液的质量分数由30%减小到1%,则吸收的氯气质量是
您最近一年使用:0次
2022-01-16更新
|
343次组卷
|
2卷引用:上海市静安区2022届高三一模化学试题
6 . 含氯化合物在生活生产中具有广泛作用。完成下列问题:
(1)含氯产品①中钢瓶上应贴的标签为______ 。

(2)关于保存液氯、液溴的说法正确的是______ 。
漂白粉的消毒能力以酸化时释放出来的氯气量作标准,用来衡量含氯消毒剂的消毒能力,以Cl%= ×100%(有效氯含量)表示。
×100%(有效氯含量)表示。
(3)漂白粉的有效成分为______ (填写化学式)。实验证实,某批次的漂白粉的碱性明显大于正常情况下的漂白粉。原因是可能该批次的产品中混有较多的______ (填写化学式)。
(4)现有一种漂白粉:Ca(OH)2•3CaCl(ClO)•nH2O的“有效氯”为40.4%,则式中n值应是______ 。
小宸同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
I.制备并收集Cl2
(5)写出制备方程式______ ,MnO2发生______ 反应(填写氧化或还原)。
(6)图1装置制备氯气中含有______ 和水蒸气,收集前需要通过装有______ 的洗气瓶除杂。

(7)有同学提出用图2装置制取氯气。

①仪器X名称为______ ;
②使用仪器X制备气体,优点在于______ 。
II.氯水相关物质的性质探究
(8)关于液氯与新制氯水叙述正确的是______ 。
(9)久置的氯水和新制的氯水相比较,下列结论正确的是______ 。
III.验证氯水中HClO光照分解的产物
将图3新制氯水置于三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


(10)若能够证明氯水中HClO在光照下发生了分解反应,则图4中纵坐标不可以表示的物理量是______ 。(注:酸性溶液中,c(H+)越大,pH越小,溶液酸性越强)
(11)氯水久置易变质,检验一瓶氯水是否已经完全变质,可选用的试剂是______ 。
(1)含氯产品①中钢瓶上应贴的标签为

A. | B. | C. | D. |
| A.液氯贮存在干燥的钢瓶中 | B.液溴保存时需加入一些苯覆盖 |
| C.常温下保存液氯应采用低压 | D.液溴应保存在棕色的广口瓶中 |
漂白粉的消毒能力以酸化时释放出来的氯气量作标准,用来衡量含氯消毒剂的消毒能力,以Cl%=
 ×100%(有效氯含量)表示。
×100%(有效氯含量)表示。(3)漂白粉的有效成分为
(4)现有一种漂白粉:Ca(OH)2•3CaCl(ClO)•nH2O的“有效氯”为40.4%,则式中n值应是
小宸同学在实验室制备、收集氯气,并进行氯水中相关物质的性质探究,回答下列问题。
I.制备并收集Cl2
(5)写出制备方程式
(6)图1装置制备氯气中含有

(7)有同学提出用图2装置制取氯气。

①仪器X名称为
②使用仪器X制备气体,优点在于
II.氯水相关物质的性质探究
(8)关于液氯与新制氯水叙述正确的是
| A.都含有氯离子 | B.都含氯分子 | C.都是电解质 | D.都能导电 |
| A.颜色相同 | B.都能使有色布条褪色 |
| C.都能使淀粉碘化钾试纸变蓝 | D.加AgNO3溶液都能生成白色沉淀 |
III.验证氯水中HClO光照分解的产物
将图3新制氯水置于三颈瓶内,将pH传感器、氯离子传感器、氧气传感器分别插入三颈瓶中,用强光照射氯水,进行实验并采集数据,获得相关变化曲线。


(10)若能够证明氯水中HClO在光照下发生了分解反应,则图4中纵坐标不可以表示的物理量是
| A.氯水的pH | B.氢离子的浓度 | C.氯离子的浓度 | D.氧气的体积分数 |
| A.硝酸银溶液 | B.酚酞溶液 | C.碳酸钠溶液 | D.紫色石蕊溶液 |
您最近一年使用:0次
23-24高三上·上海浦东新·阶段练习
名校
解题方法
7 . 海水中的卤素资源。地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面,是蕴藏着极为丰富化学资源的“聚宝盆”,其中氯化物含量很高,氯和同族的氟、溴、碘、砹总称为卤素。
(1)氯气是一种重要的化工原料,可用以下几种方法制取氯气。
a.实验室可用二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:___________ 。
b.工业上电解饱和食盐水制氯气,写出其反应的离子方程式:___________ 。
c.氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为___________ 。
(2)将氯气分别通入含下列离子的溶液中,离子浓度减小的是___________ 。
(3)氯气的水溶液即氯水,某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是___________ 。

(1)氯气是一种重要的化工原料,可用以下几种方法制取氯气。
a.实验室可用二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:
b.工业上电解饱和食盐水制氯气,写出其反应的离子方程式:
c.氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为
(2)将氯气分别通入含下列离子的溶液中,离子浓度减小的是
A. | B. | C. | D. |

| A.图1表示氯水pH随时间的变化 |
| B.图2表示溶液中氯离子浓度随时间的变化 |
| C.图3表示氯水的电导率随时间的变化 |
| D.图4表示液面上方氧气体积分数随时间的变化 |
您最近一年使用:0次
解题方法
8 . 氯水及氯的许多化合物是高效广谱的消毒剂,同时又是生产中重要的化工原料,根据所学知识,回答下列问题:
(1)新制的氯水呈淡黄色,向氯水中滴入几滴AgNO3溶液,现象是___ ,说明氯水中有存在____ 。
(2)某品牌的“84”消毒液含NaClO的质量分数约为6%,NaClO溶液能够杀灭新冠病毒的原因是____ ;为了较长时间保持NaClO溶液的杀菌能力,NaClO溶液应密闭避光保存,原因是___ 。生活中,若不小心将“84”消毒液与洁厕剂(含有盐酸)混合后,易生成___ 气体(填化学式),能使人中毒。
(3)近些年来,科学家提出使用ClO2对自来水进行消毒。以NaClO2和稀盐酸为原料可制备ClO2,写出该反应的化学方程式:___ ,在上述过程中被氧化和被还原的物质的物质的量之比为____ 。
(1)新制的氯水呈淡黄色,向氯水中滴入几滴AgNO3溶液,现象是
(2)某品牌的“84”消毒液含NaClO的质量分数约为6%,NaClO溶液能够杀灭新冠病毒的原因是
(3)近些年来,科学家提出使用ClO2对自来水进行消毒。以NaClO2和稀盐酸为原料可制备ClO2,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . 生活中用到的自来水常用氯气消毒,其消毒效果好,成本低.饮用水的酸碱度、 含量是评判水质的重要参数,国家规定使用含氯消毒剂消毒后,自来水余氯含量
含量是评判水质的重要参数,国家规定使用含氯消毒剂消毒后,自来水余氯含量 ,自来水出厂前,检验人员需对自来水进行酸碱度与
,自来水出厂前,检验人员需对自来水进行酸碱度与 含量的测定。
含量的测定。
请回答下列问题:
(1)氯气通入自来水中起到杀菌、消毒作用的是______ (填化学式),利用了该物质具有______ 的性质,其中氯元素的化合价是______ ,写出产生该物质的离子方程式:______ 。
(2)取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加36%的浓盐酸溶液、98%的浓硫酸溶液、新制氯水,三张试纸最终所呈现的颜色分别是______ 、______ 、______ 。
(3)生产、生活中常见的含氯消毒剂包含氯气、84消毒液(NaClO)、漂白粉 、
、 等,下列关于氯及其化合物的叙述正确的是
等,下列关于氯及其化合物的叙述正确的是______ (填字母标号)。
a.将食醋加入“84”消毒液中,会减弱其杀菌、消毒效果
b.漂白粉的主要成分是 ,主要用于杀菌、消毒
,主要用于杀菌、消毒
c.漂白液和洁厕灵(主要含HCl)两种都是消毒剂,一起用效果更好
d.工业生产中是将氯气通入冷的石灰乳中制取漂白粉
 含量是评判水质的重要参数,国家规定使用含氯消毒剂消毒后,自来水余氯含量
含量是评判水质的重要参数,国家规定使用含氯消毒剂消毒后,自来水余氯含量 ,自来水出厂前,检验人员需对自来水进行酸碱度与
,自来水出厂前,检验人员需对自来水进行酸碱度与 含量的测定。
含量的测定。请回答下列问题:
(1)氯气通入自来水中起到杀菌、消毒作用的是
(2)取三张蓝色石蕊试纸湿润后贴在玻璃片上,然后按顺序分别滴加36%的浓盐酸溶液、98%的浓硫酸溶液、新制氯水,三张试纸最终所呈现的颜色分别是
(3)生产、生活中常见的含氯消毒剂包含氯气、84消毒液(NaClO)、漂白粉
 、
、 等,下列关于氯及其化合物的叙述正确的是
等,下列关于氯及其化合物的叙述正确的是a.将食醋加入“84”消毒液中,会减弱其杀菌、消毒效果
b.漂白粉的主要成分是
 ,主要用于杀菌、消毒
,主要用于杀菌、消毒c.漂白液和洁厕灵(主要含HCl)两种都是消毒剂,一起用效果更好
d.工业生产中是将氯气通入冷的石灰乳中制取漂白粉
您最近一年使用:0次
10 . 氯离子是维持血清电解质平衡和酸碱平衡重要物质,人体中氯的正常值范围是96~106mmol∙L−1,氯及其化合物在生活中也有着重要用途。下图为氯及其化合物的“价—类”二维图。

(1)若经体检测得某人体内 含量为
含量为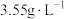 ,此测量值
,此测量值_______ (填“处于”或“不处于”)人体中氯的正常值范围内。
(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将 传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。
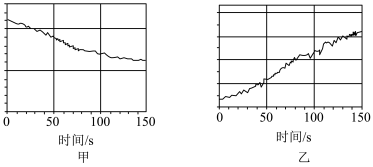
图甲和图乙的纵坐标可能分别为_______ (填序号)。
A.氯水的 、离子浓度 B.氯离子浓度、氯水的
、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的
该过程的化学反应方程式为_______ 。
(3)某同学想利用以下试剂探究 的化学性质:
的化学性质:
A. B.
B. C.
C. D.
D.
i.从物质类别的视角, 属于强酸,可能与
属于强酸,可能与_______ 发生反应(填序号)。
ii.从元素价态的视角, 具有氧化性,可能与
具有氧化性,可能与_______ 发生反应(填序号)。
(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量 可用如下方法:
可用如下方法: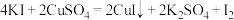 。请根据方程式回答问题:
。请根据方程式回答问题:
①从上述反应中可以判断 和
和 氧化性的关系为
氧化性的关系为_______ >_______ 。
②反应有 生成,转移
生成,转移_______  电子。
电子。

(1)若经体检测得某人体内
 含量为
含量为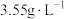 ,此测量值
,此测量值(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将
 传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。

图甲和图乙的纵坐标可能分别为
A.氯水的
 、离子浓度 B.氯离子浓度、氯水的
、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的

该过程的化学反应方程式为
(3)某同学想利用以下试剂探究
 的化学性质:
的化学性质:A.
 B.
B. C.
C. D.
D.
i.从物质类别的视角,
 属于强酸,可能与
属于强酸,可能与ii.从元素价态的视角,
 具有氧化性,可能与
具有氧化性,可能与(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量
 可用如下方法:
可用如下方法: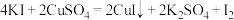 。请根据方程式回答问题:
。请根据方程式回答问题:①从上述反应中可以判断
 和
和 氧化性的关系为
氧化性的关系为②反应有
 生成,转移
生成,转移 电子。
电子。
您最近一年使用:0次






