19-20高三·江西南昌·阶段练习
解题方法
1 . 三氯化硼的熔点-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为:B2O3+3C+3Cl2 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
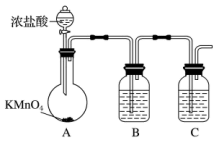
①装置B的作用是___________ ,装置C中盛放的试剂是___________ 。
②装宜A中发生反应的离子方程式为_______________ 。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
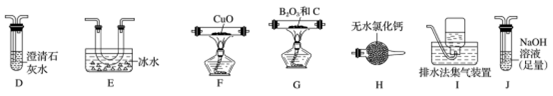
①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。____________
②能证明反应中有CO生成的现象是_____________ 。
③开始反应时,先后(选填下列序号)______________ 。
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式_____________ 。
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象____________ 。
 2BCl3+3CO。
2BCl3+3CO。(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B的作用是
②装宜A中发生反应的离子方程式为
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。

①乙组同学的实验装置中依次连接的合理顺序为:
A→B→C→G→___→____→____→____→F→____→____→_____。
②能证明反应中有CO生成的现象是
③开始反应时,先后(选填下列序号)
a.点燃G处酒精灯b.打开A处分液漏斗活塞
④BCl3易水解,写出BCl3水解的化学方程式
⑤硼酸是一元弱酸,Ka=-5.8×10-10,碳酸的Ka1=4.4×10-7,现提供饱和的硼酸溶液和0.1mol/LNa2CO3溶液,设计实验证明硼酸酸性比碳酸弱。简述操作和现象
您最近一年使用:0次
名校
解题方法
2 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装霞省略)制备KC1O3和NaClO,探究其氧化还原性质。

回答下列问题:
(1)圆底烧瓶中发生的离子方程式_____ 。
(2)c中化学反应的离子方程式是______ ,采用冰水浴冷却的目的是______ 。
(3)d的作用是______ ,可选用试剂______ (填标号)。
A.Na2S B.NaCl C.Ca(OH)2悬浊液 D.H2SO4
(4)取少量KC1O3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CC14振荡,静置后CC14层显____ 色。可知该条件下KC1O3的氧化能力_____ NaClO(填“大于”或“小于”)。
(5)C12O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和C12反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备C12O的化学方程式为_____ 。
(6)C1O2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,逸出大量气泡,得到C1O2溶液。上述过程中,生成C1O2的反应属于歧化反应,每生成1mol C1O2消耗NaClO2的物质的量为_____ mol;产生“气泡”的化学方程式为_____ 。

回答下列问题:
(1)圆底烧瓶中发生的离子方程式
(2)c中化学反应的离子方程式是
(3)d的作用是
A.Na2S B.NaCl C.Ca(OH)2悬浊液 D.H2SO4
(4)取少量KC1O3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CC14振荡,静置后CC14层显
(5)C12O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和C12反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备C12O的化学方程式为
(6)C1O2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,逸出大量气泡,得到C1O2溶液。上述过程中,生成C1O2的反应属于歧化反应,每生成1mol C1O2消耗NaClO2的物质的量为
您最近一年使用:0次
名校
解题方法
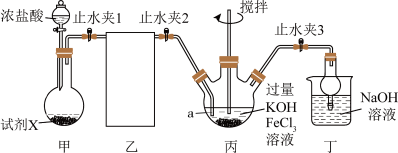
3 . 高铁酸盐在污水处理,水体消杀等方面用途广泛。高铁酸钾( )是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备
)是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备 。回答下列问题:
。回答下列问题:
已知 的部分性质如下:
的部分性质如下:
(1)仪器a的名称是________________ 。
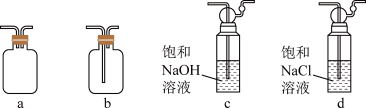
(2)装置乙可选用下列________ (填标号)。
(3)连接好装置乙后,需对装置气密性进行检查,写出整套装置的气密性检查方法及气密性良好的现象:_________________________________ 。
(4)装置甲中的试剂X为锰的一种化合物,写出装置甲中发生的离子反应式____________ 。
(5)制备过程中,装置丙需采用冰水浴,目的是__________________________ ,该装置中以1molFeCl3为原料,完全转化为K2FeO4需要消耗KOH________ g。
(6)装置丁的作用是_________________________________ 。
 )是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备
)是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备 。回答下列问题:
。回答下列问题:
已知
 的部分性质如下:
的部分性质如下:| 溶解性 | 溶于水,微溶于浓KOH溶液,难溶于有机物 |
| 稳定性 | 温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2 |
(2)装置乙可选用下列

(3)连接好装置乙后,需对装置气密性进行检查,写出整套装置的气密性检查方法及气密性良好的现象:
(4)装置甲中的试剂X为锰的一种化合物,写出装置甲中发生的离子反应式
(5)制备过程中,装置丙需采用冰水浴,目的是
(6)装置丁的作用是
您最近一年使用:0次
2020-10-18更新
|
375次组卷
|
2卷引用:湖北省部分重点中学2021届高三上学期10月联考化学试题
名校
4 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
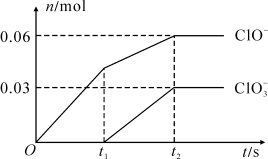
 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是
| A.原溶液中KOH的物质的量是0.3 mol |
B. 的生成是由氯气的量的多少引起的 的生成是由氯气的量的多少引起的 |
| C.反应中转移电子的物质的量是0.21 mol |
D.依据图象,总的离子反应方程式为10OH-+5Cl2=2C1O-+ +7Cl-+5H2O +7Cl-+5H2O |
您最近一年使用:0次
2020-10-10更新
|
950次组卷
|
4卷引用:黑龙江省大庆实验中学2021届高三上学期第一次月考化学试题
名校
解题方法
5 . “84消毒液”广泛应用于杀菌消毒,其有效成分是NaClO。实验小组制备消毒液,并利用其性质探索制备碘水的方法。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I- I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。
Ⅰ.制备消毒液(夹持装置略)
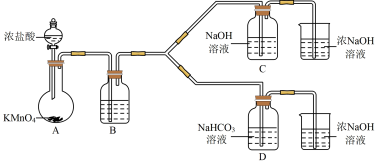
(1)制备NaClO消毒液的装置是__________ (填C或D)。
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用___________________ 。
(3)结合资料i,写出D中反应的化学方程式______________________ 。
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(4)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是________ 。
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是_____________ 。
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是______________________ 。
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由______________________ 。
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据________ 。
资料:i.HClO的电离常数为Ka=4.7×10-8;
H2CO3的电离常数为K1=4.3×10-7、K2=5.6×10-11。
ii.碘的化合物主要以I-和IO3-的形式存在,IO3-+5I-+6H+=3I2+3H2O。
iii.碘单质能与I-反应:I2+I-
 I3-(I3-低浓度时显黄色,高浓度时为棕色)。
I3-(I3-低浓度时显黄色,高浓度时为棕色)。Ⅰ.制备消毒液(夹持装置略)

(1)制备NaClO消毒液的装置是
(2)制备完成后,向C装置的溶液中添加NaOH、Na2SiO3等物质,得到与某品牌成分相同的消毒液,用平衡移动原理解释NaOH的作用
(3)结合资料i,写出D中反应的化学方程式
Ⅱ.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9gKI固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9gKI固体再加入1mo/L盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量KI固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
(5)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:过量的NaClO将反应生成的I2氧化为IO3-。
设计实验证实了假设1成立。NaClO氧化I2生成IO3-的离子方程式是
假设2:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设2成立,实验a的操作及现象是
(6)某小组检验烧杯3所得溶液中含IO3-:取烧杯3所得无色溶液少许,加入稀硫酸酸化的KI溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在IO3-,说明理由
(7)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
您最近一年使用:0次
2020-05-07更新
|
450次组卷
|
4卷引用:北京市第八十中学2024届高三上学期10月月考化学试题
北京市第八十中学2024届高三上学期10月月考化学试题北京市石景山区2020届高三第一次模拟化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究北京首都师范大学附属中学2022届高三下学期三模化学试题
6 . 设NA为阿伏加 德罗常数的值,下列说法正确的是
| A.将 1mol Cl2通入到水中,则N(HClO ) + N(Cl—) + N(ClO—)=2NA |
| B.34g H2O2和H2S混合物中的氢原子数为2NA |
| C.含NA个阴离子的 Na2O2溶于水形成1 L溶液,Na+浓度为1 mol·L-1 |
| D.标准状况下,22.4L甲醇所含的分子数目为NA |
您最近一年使用:0次
名校
解题方法
7 . 用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)并进行相关实验,电解一段时间后,各部分装置及对应的现象如下:
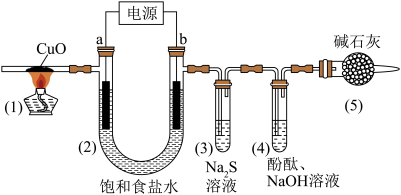
下列对实验现象解释不正确 的是( )

| 对应现象 | (1)中黑色固体变红 | (2)电极a附近溶液出现浑浊 | (3)中溶液出现浑浊 | (4)中溶液红色褪去 |
A.(1)中:CuO+H2 Cu+H2O Cu+H2O |
| B.(2)中a电极:2H2O+2e-=H2↑+2OH-,Mg2++2OH-=Mg(OH)2↓ |
| C.(3)中:Cl2+S2-=S↓+2Cl- |
D.(4)中:Cl2+H2O HCl + HClO HCl + HClO |
您最近一年使用:0次
2020-01-13更新
|
369次组卷
|
2卷引用:北京市顺义牛栏山第一中学2021-2022学年高三上学期10月月考化学试题
8 . 下列关于氯及其化合物的叙述正确的是( )
| A.氯气的性质很活泼,它与氢气混合后立即发生爆炸 |
| B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用饱和食盐水吸收 |
| C.久置的氯水没有漂白性 |
D.检验HCl气体中是否混有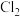 的方法是将气体通入硝酸银溶液 的方法是将气体通入硝酸银溶液 |
您最近一年使用:0次
2019-11-18更新
|
152次组卷
|
3卷引用:福建省三明市尤溪第一中学2019-2020学年高一上学期第一次月考化学试题
福建省三明市尤溪第一中学2019-2020学年高一上学期第一次月考化学试题福建省泉州市2019-2020学年高一上学期期中考试化学试题(已下线)2.2.1氯气的性质(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)
9 . A、B、C、D、E、X均为短周期元素形成的无机物,存在如图所示转化关系(部分生成物和反应条件略去);已知A 由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:
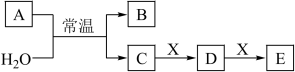
(1)若A为单质,且C为一元强酸。
①化合物B 的结构式为_______ 。
②写出一种工业制备单质A的离子方程式:________ 。
③X可能为______ (填字母代号)。
a.NaOH b.AlCl3 c.Na2CO3 d.Na[Al(OH)4]
(2)若A为两种元素形成的化合物,且E与水反应生成的G的浓溶液遇C有白烟产生。
①A的电子式为______ 。
②A与H2O反应的化学方程式为_____ 。
③室温下,NH2OH(羟氨)会发生分解生成C、D,试写出其分解反应的化学方程式_________ 。

(1)若A为单质,且C为一元强酸。
①化合物B 的结构式为
②写出一种工业制备单质A的离子方程式:
③X可能为
a.NaOH b.AlCl3 c.Na2CO3 d.Na[Al(OH)4]
(2)若A为两种元素形成的化合物,且E与水反应生成的G的浓溶液遇C有白烟产生。
①A的电子式为
②A与H2O反应的化学方程式为
③室温下,NH2OH(羟氨)会发生分解生成C、D,试写出其分解反应的化学方程式
您最近一年使用:0次
2019-10-18更新
|
241次组卷
|
3卷引用:山东省泰安市第一中学2020届高三10月月考化学试题
10 . 下列实验现象描述正确的是
| A.铜与氯气反应产生棕黄色的烟,加水后溶液呈蓝绿色 |
| B.铁与稀硫酸反应,产生大量的气体,生成棕黄色溶液 |
| C.氢气在氯气中燃烧产生苍白色烟雾,生成有刺激性气味的气体 |
| D.钠在氧气中燃烧发出白色光,生成淡黄色固体 |
您最近一年使用:0次



