解题方法
1 . 根据要求回答下列问题:
(1)amol单质碳和16g氧气恰好在某恒容密闭容器中发生反应: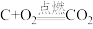 、
、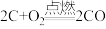 ,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
①a=_______ ;16g氧气的体积为_______ L(标准状况下)
②若将反应后的气体通过盛有足量Na2O2的U形管,发生反应的化学方程式为_______ 。
(2)二氧化氯(ClO2)是一种广谱杀菌消毒剂。某工厂以213gNaClO3固体、117gNaCl固体和876g一定溶质质量分数的稀硫酸为原料制取ClO2,反应的化学方程式为2NaClO3+2NaCl+2H2SO4=2ClO2 +Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
+Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
①NaClO2中Cl的化合价是_______
②“84消毒液”也是一种含氯消毒剂,写出实验室制备“84消毒液”的化学方程式:_______
③876g稀硫酸中H2SO4的质量分数是_______ %(结果保留1位小数)。
④30℃时,将所得的硫酸钠溶液蒸发掉_______ g水可以恰好形成该温度下的饱和溶液(已知:30℃时,Na2SO4的溶解度为40g)。
(1)amol单质碳和16g氧气恰好在某恒容密闭容器中发生反应:
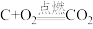 、
、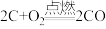 ,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。
,当恢复到原来的温度时,测得容器内的压强增大了0.5倍(忽略固体对压强的影响)。①a=
②若将反应后的气体通过盛有足量Na2O2的U形管,发生反应的化学方程式为
(2)二氧化氯(ClO2)是一种广谱杀菌消毒剂。某工厂以213gNaClO3固体、117gNaCl固体和876g一定溶质质量分数的稀硫酸为原料制取ClO2,反应的化学方程式为2NaClO3+2NaCl+2H2SO4=2ClO2
 +Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。
+Cl2↑+2H2O+2Na2SO4,假设反应物均恰好完全反应。①NaClO2中Cl的化合价是
②“84消毒液”也是一种含氯消毒剂,写出实验室制备“84消毒液”的化学方程式:
③876g稀硫酸中H2SO4的质量分数是
④30℃时,将所得的硫酸钠溶液蒸发掉
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)Cl2通入水中制氯水,反应的离子方程式:____ 。
(2)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式:____ 。
(3)以软锰矿(主要成分为MnO2、SiO2等)为原料制备高纯MnO2的流程如图:
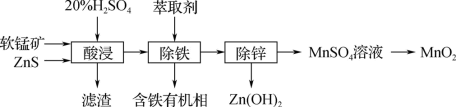
①滤渣中含大量硫单质,酸浸时主要反应的化学方程式:____ 。
②酸性条件下,用合适的氧化剂可以将MnSO4转化为高纯MnO2。用NaClO3作氧化剂时会同时产生NaCl,该反应的离子方程式:____ 。
(4)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定某次试验所得溶液中次氯酸的物质的量浓度:量取10.00mL上述次氯酸溶液,并稀释至100mL,再从其中取出10.00mL于锥形瓶中,并加入10.00mL0.8000mol/L的FeSO4溶液,充分反应后,用0.05000mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00mL,则原次氯酸溶液的浓度为____ (写出计算过程)。
(1)Cl2通入水中制氯水,反应的离子方程式:
(2)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式:
(3)以软锰矿(主要成分为MnO2、SiO2等)为原料制备高纯MnO2的流程如图:

①滤渣中含大量硫单质,酸浸时主要反应的化学方程式:
②酸性条件下,用合适的氧化剂可以将MnSO4转化为高纯MnO2。用NaClO3作氧化剂时会同时产生NaCl,该反应的离子方程式:
(4)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定某次试验所得溶液中次氯酸的物质的量浓度:量取10.00mL上述次氯酸溶液,并稀释至100mL,再从其中取出10.00mL于锥形瓶中,并加入10.00mL0.8000mol/L的FeSO4溶液,充分反应后,用0.05000mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00mL,则原次氯酸溶液的浓度为
您最近一年使用:0次
3 . “84消毒液”是一种以NaClO为主的高效消毒剂,某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)使用。

(1)此“84消毒液”的物质的量浓度约为_______ 。
(2)工业上以氯气和氢氧化钠溶液为原料制取“84消毒液”,若要制取10L该消毒液,需要标准状况下的Cl2_______ L。

(1)此“84消毒液”的物质的量浓度约为
(2)工业上以氯气和氢氧化钠溶液为原料制取“84消毒液”,若要制取10L该消毒液,需要标准状况下的Cl2
您最近一年使用:0次
20-21高一·浙江·阶段练习
4 . Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3,c(Cl-)和c(ClO-)的比值与反应温度有关。用32gNaOH配成的100mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化)。
(1)参加反应的Cl2的物质的量是__ 。
(2)某温度下,反应后溶液中c(Cl-)=8c(ClO ),则溶液中c(ClO-)=
),则溶液中c(ClO-)=__ 。
(1)参加反应的Cl2的物质的量是
(2)某温度下,反应后溶液中c(Cl-)=8c(ClO
 ),则溶液中c(ClO-)=
),则溶液中c(ClO-)=
您最近一年使用:0次
21-22高一上·浙江·阶段练习
5 . 实验室制取氯气,将多余的氯气用100 mL 1.7 mol·L-1的氢氧化钠溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH- )=0.1 mol·L-1 (不考虑反应前后溶液的体积变化)。ClO-和ClO 的物质的量浓度之比为5:1。
的物质的量浓度之比为5:1。
(1)吸收氯气消耗氢氧化钠的物质的量为_______ 。
(2)被氧化氯气与被还原氯气的物质的量之比为_______ 。
 的物质的量浓度之比为5:1。
的物质的量浓度之比为5:1。(1)吸收氯气消耗氢氧化钠的物质的量为
(2)被氧化氯气与被还原氯气的物质的量之比为
您最近一年使用:0次
解题方法
6 . 氧化还原反应是一类重要的化学反应,在工农生产科学技术和日常生活中都有广泛的应用。
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:___________ 。
② 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应___________ 。□H++□ +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O
(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为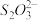 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为______ 。
②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为_______________ 。
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度____ ,判断其 血液含钙量__________ (填“正常”或“不正常”)。(已知:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O)
(1)①“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+,请写出该反应的离子方程式:
②
 毒性较强,常用NaHSO3处理工业废水中的
毒性较强,常用NaHSO3处理工业废水中的 ,请配平该反应
,请配平该反应 +□
+□ =口Cr3++□
=口Cr3++□ +□H2O
+□H2O(2)①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯对鱼的危害。脱氯反应为
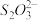 +4Cl2 +5H2O=2
+4Cl2 +5H2O=2 + 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为
+ 10H++8Cl-,若反应中消耗了4.48 L(标准状况)的Cl2,则转移的电子数目为②用HI和淀粉溶液可以检验加碘盐中是否存在KIO3,原理为KIO3+6HI=3I2+ KI +3H2O,氧化剂和还原剂的物质的量之比为
③钙元素是人体必须的常量元素,所有的细胞都需要钙元素。正常人体血液含Ca2+为2.2×10-3 ~2.7×10-3 mol/L。现抽取某人血样10 mL,稀释后用草酸铵[ (NH4)2C2O4]溶液处理,使Ca2+完全转变为草酸钙(CaC2O4)沉淀;过滤,洗涤,将得到的沉淀用稀硫酸溶解可得到草酸(H2C2O4),并用2.0 mL5.0×10-3 mol/LKMnO4溶液与溶解得到的草酸恰好完全反应。则此人血液中Ca2+的浓度
您最近一年使用:0次
7 . 计算题(写出计算过程)。
化学实验室中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。若有3.20g氢氧化钠发生了化学反应,试求:
(1)生成NaCl的质量______ 。
(2)生成NaClO的物质的量______ 。
(3)被吸收的氯气在标准状况下的体积______ 。
化学实验室中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。若有3.20g氢氧化钠发生了化学反应,试求:
(1)生成NaCl的质量
(2)生成NaClO的物质的量
(3)被吸收的氯气在标准状况下的体积
您最近一年使用:0次
名校
8 . 一定量的H2在Cl2中燃烧后,所得混合气体用100 mL 3.00 mol/L的NaOH溶液恰好完全吸收,测得溶液中含0.03 mol NaClO(不考虑水解)。氢气和氯气物质的量之比为多少?
您最近一年使用:0次
名校
解题方法
9 . 氯及其化合物是中学化学中的重要研究对象。
(1)写出实验室中制取氯气的离子方程式___ ;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为___ ;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是___ 。向反应后的集气瓶中加入适量的蒸馏水,振荡,观察到的现象是___ 。
(1)写出实验室中制取氯气的离子方程式
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)→KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是
您最近一年使用:0次
10 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1 mol的H2O完全反应会生成2 mol的HCl,则X的组成元素是______________ ;已知X的相对分子质量为153.5,则X的化学式为________________ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07 g X与448 mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2____ mol,气体的体积将变为_____ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.48 g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.55 g,计算产物中PCl3的质量分数____________ (保留3小数)。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1 mol的H2O完全反应会生成2 mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07 g X与448 mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.48 g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.55 g,计算产物中PCl3的质量分数
您最近一年使用:0次



