名校
解题方法
1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
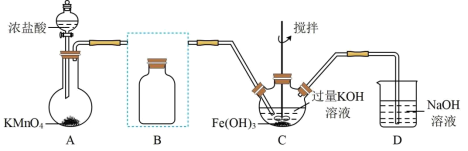
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
2 . 利用下图,可以从不同角度研究含氯物质的性质及其转化关系,图中甲~辛均含氯元素。回答下列问题:

(1)丙的化学式为_______ ;从组成和性质上分析,丁属于_______ (填“酸性”或“碱性”)氧化物。
(2)图中甲、乙、丁、戊中,属于电解质的是__________ (填化学式);根据氯元素的化合价判断,乙物质__________ 。
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是______ 。
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为_________ 。
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是____ 。

(1)丙的化学式为
(2)图中甲、乙、丁、戊中,属于电解质的是
a 只有氧化性 b 既有氧化性又有还原性
c 只有还原性 d 既能做氧化剂也能做还原剂
(3)电解甲溶液制备己的化学反应为:甲+ H2O→己+H2↑,反应中甲与H2O的物质的量之比是
(4)庚是漂白粉的有效成分,用乙制取庚的化学反应方程式为
(5)辛在MnO2催化下受热分解可用于制备一种常见气体,这种气体的化学式是
您最近一年使用:0次
2020-03-15更新
|
265次组卷
|
4卷引用:山东省淄博市2019-2020学年高一上学期期末质量检测化学试题
山东省淄博市2019-2020学年高一上学期期末质量检测化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】72云南省大理州祥云县2019-2020学年高一下学期期末统测化学试题
名校
3 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
(1)阅读资料,回答下列相关问题。
①以上画横线的物质中:属于电解质的有_______ 种;其中属于酸式盐的物质的电离方程式_______ 。
②Cl2与NaOH溶液反应的离子方程式是_______ 。
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应: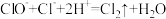 。
。
①该反应中起氧化作用的微粒是_______ 。
②若反应中生成了0.01molCl2,转移电子的物质的量为_______ mol。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO_______ H2O2(填“>”或“<”)。
(1)阅读资料,回答下列相关问题。
| 资料:人们常用“84”消毒液进行消毒。“84”消毒液的名称源于北京某医院在1984年研制成功的一种高效含氯消毒剂。“84”消毒液呈无色或淡黄色,可由Cl2和NaOH溶液反应制得,其主要成分为NaClO、NaCl。发挥漂白作用时NaClO与空气中的CO2、H2O反应生成NaHCO3和HClO。 |
②Cl2与NaOH溶液反应的离子方程式是
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:
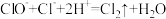 。
。①该反应中起氧化作用的微粒是
②若反应中生成了0.01molCl2,转移电子的物质的量为
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO
您最近一年使用:0次
解题方法
4 . 氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。

(1)盛装浓盐酸的仪器名称是_______ 。
(2)装置A烧瓶中反应的化学方程式为_______ 。
(3)装置C中 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为_______ 。
(4)如果缺少装置B,对制取NaClO和 的影响是
的影响是_______ 。
(5)E中可选用试剂有_______ (填标号)。
A.饱和 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液
(6)该小组在探究 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为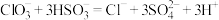 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:
该实验_______ (填“能”或“不能”)达到实验目的,理由是_______ 。
 ,制备装置如图所示(部分加持仪器略去),并研究
,制备装置如图所示(部分加持仪器略去),并研究 的氧化性。已知:氯气与碱反应,温度较高时生成
的氧化性。已知:氯气与碱反应,温度较高时生成 ,温度较低时生成
,温度较低时生成 。
。
(1)盛装浓盐酸的仪器名称是
(2)装置A烧瓶中反应的化学方程式为
(3)装置C中
 与试剂a反应的离子方程式为
与试剂a反应的离子方程式为(4)如果缺少装置B,对制取NaClO和
 的影响是
的影响是(5)E中可选用试剂有
A.饱和
 溶液 B.浓
溶液 B.浓 C.饱和NaCl溶液 D.NaOH溶液
C.饱和NaCl溶液 D.NaOH溶液(6)该小组在探究
 氧化性时,发现
氧化性时,发现 与
与 的反应速率先增大后减小,反应为
的反应速率先增大后减小,反应为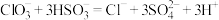 。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究
。小组分析认为,反应生成的离子可能对反应速率产生影响。为了探究 对化学反应速率的影响,设计如下实验:
对化学反应速率的影响,设计如下实验:| 实验序号 | 温度 |  |  |  盐酸 盐酸 |  |
| ① | 25℃ | 10mL | 10mL | 0mL | 1mL |
| ② | 25℃ | 10mL | 10mL | 1mL | 0mL |
您最近一年使用:0次
2021-06-17更新
|
401次组卷
|
2卷引用:山东省临朐县实验中学2020-2021学年高一7月月考化学试题
名校
解题方法
5 . 高铁酸钾(K2FeO4)是一种高效多功能的新型非氯绿色消毒剂,在水处理中有广泛的前景。如图是实验室利用氢氧化铁、氯气和氢氧化钾制备高铁酸钾的部分装置图。

已知:①在较高温度下,氯气和KOH反应速率过快产生KClO3,导致K2FeO4产率降低。
②K2FeO4具有下列性质:K2FeO4为紫色固体,易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、在强碱性溶液中比较稳定。
下列说法错误的是

已知:①在较高温度下,氯气和KOH反应速率过快产生KClO3,导致K2FeO4产率降低。
②K2FeO4具有下列性质:K2FeO4为紫色固体,易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、在强碱性溶液中比较稳定。
下列说法错误的是
| A.甲中橡胶管的作用是平衡体系内的压强,确保浓盐酸能顺利流下 |
| B.乙中溶液的作用之一是除去氯气中的氯化氢 |
| C.通入N2的作用为降低氯气的浓度,防止氯气和KOH反应速率过快产生KClO3 |
| D.丙中发生反应的氧化剂与还原剂的物质的量之比为2∶3 |
您最近一年使用:0次
2023-01-10更新
|
261次组卷
|
2卷引用:山东省烟台第一中学2022-2023学年高一上学期月考化学试题
6 . 某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为Ca(ClO)2+CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:

(1)该实验中A部分的装置是_____ (填字母)。
(2)装置B中的现象是_____ 。
(3)请写出装置C中发生反应的离子方程式:_____ 。请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):______ 。
(4)装置E的作用是______ 。
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:______ (用化学方程式表示)。
 2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
2CaSO4+2Cl2↑+2H2O,他们设计如图实验装置制取氯气并验证其性质。请回答下列问题:
(1)该实验中A部分的装置是

(2)装置B中的现象是
(3)请写出装置C中发生反应的离子方程式:
(4)装置E的作用是
(5)制取Cl2的方法有多种,若A部分的装置是a,请再写出一种制备方法:
您最近一年使用:0次
解题方法
7 . 某化学兴趣小组设计了如图装置制取Cl2进行相关性质实验,并模拟工业生产无水氯化铁的过程。
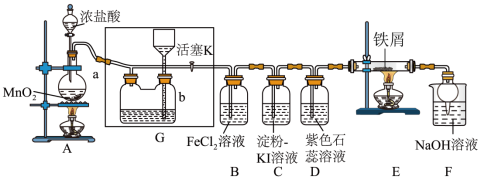
资料:①工业上向500~600℃的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。装置G中的液体是饱和氯化钠溶液,用于储存反应后多余的氯气。
根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为______ ,A中发生反应的离子方程式为______ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①装置B中发生反应的化学方程式为______ 。
②装置C和D中看到的实验现象分别是______ 、______ 。
(3)若要得到较纯净的无水氯化铁,上述装置的改进措施是:______ 。

资料:①工业上向500~600℃的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。装置G中的液体是饱和氯化钠溶液,用于储存反应后多余的氯气。
根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①装置B中发生反应的化学方程式为
②装置C和D中看到的实验现象分别是
(3)若要得到较纯净的无水氯化铁,上述装置的改进措施是:
您最近一年使用:0次
8 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
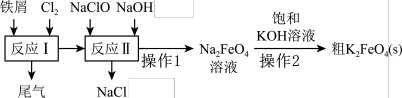
下列叙述不正确的是

下列叙述不正确的是
| A.反应I产生的尾气可通入澄清石灰水中吸收 |
| B.反应I生成的FeCl3,在碱性条件下会被NaClO氧化成Na2FeO4 |
| C.反应II中每消耗3个ClO-转移6个电子 |
| D.Na2FeO4转化成K2FeO4的反应是氧化还原反应 |
您最近一年使用:0次
名校
9 . 某化学实验小组利用下图所示装置制备 并进行性质验证,下列说法中正确的是
并进行性质验证,下列说法中正确的是
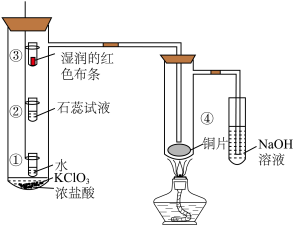
 并进行性质验证,下列说法中正确的是
并进行性质验证,下列说法中正确的是
A.①处小试管中溶液逐渐变成浅绿色说明 能溶于水 能溶于水 |
| B.②处石蕊试液先变红说明新制氯水具有酸性 |
C.③处湿润的红色布条褪色说明 具有漂白性 具有漂白性 |
D.④处出现棕黄色的烟说明 具有还原性 具有还原性 |
您最近一年使用:0次
2023-02-14更新
|
258次组卷
|
5卷引用:山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题
山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题山东省青岛第三十九中学2023-2024学年高一上学期期中考试化学试卷陕西省渭南市大荔县2022-2023学年高一上学期期末考试(鲁科版)化学试题陕西省渭南市大荔县2022-2023学年高一上学期期末考试(人教版)化学试题(已下线)第02讲 氯气的性质及实验室制法-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)
10 . Ⅰ.在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反映均为放热反应)。生成物中含有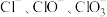 三种含氯元素的离子,其中
三种含氯元素的离子,其中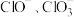 两种离子的物质的量
两种离子的物质的量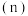 与反应时间(
与反应时间( )的曲线如图所示。
)的曲线如图所示。

(1) 时刻之前发生的反应是:
时刻之前发生的反应是:_______ 。
(2) 时,
时, 与
与 发生反应的总化学方程式为
发生反应的总化学方程式为 ,该反应中氯气的作用是
,该反应中氯气的作用是_______ ;则该石灰乳中含有 的物质的量是
的物质的量是_______ mol。
(3)据分析,生成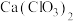 的反应是由温度升高引起的,通入
的反应是由温度升高引起的,通入 的速度不同,
的速度不同, 和
和 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后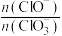
_______ 2(填“>”“<”或“=”);氯酸钙 为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施
为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施_______ (写一条即可)。
(4)请配平一下化学方程式: 。若反应过程中转移
。若反应过程中转移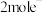 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为_______ L。
Ⅱ.有下列三个在溶液中发生的氧化还原反应:
① ;
;
②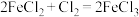
③
请根据上述反应分析推断后回答下列问题:
(5) 的氧化性由强到弱依次是
的氧化性由强到弱依次是_______ 。
(6)在酸性溶液中存在大量的 ,则
,则 中能与
中能与 大量共存的离子是
大量共存的离子是_______ 。
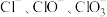 三种含氯元素的离子,其中
三种含氯元素的离子,其中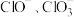 两种离子的物质的量
两种离子的物质的量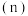 与反应时间(
与反应时间( )的曲线如图所示。
)的曲线如图所示。
(1)
 时刻之前发生的反应是:
时刻之前发生的反应是:(2)
 时,
时, 与
与 发生反应的总化学方程式为
发生反应的总化学方程式为 ,该反应中氯气的作用是
,该反应中氯气的作用是 的物质的量是
的物质的量是(3)据分析,生成
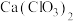 的反应是由温度升高引起的,通入
的反应是由温度升高引起的,通入 的速度不同,
的速度不同, 和
和 的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后
的比例也不同。若在原石灰乳中通入氯气的速度加快,则反应后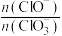
 为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施
为有毒化学品,其粉尘对呼吸道、眼及皮肤有刺激性,吸入氯酸钙粉尘,会因积累在体内而引起中毒。为了防止使用漂白粉时出现意外,制备漂白粉时可以采取的措施(4)请配平一下化学方程式:
 。若反应过程中转移
。若反应过程中转移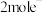 ,则生成标准状况下
,则生成标准状况下 的体积为
的体积为Ⅱ.有下列三个在溶液中发生的氧化还原反应:
①
 ;
;②
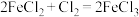
③

请根据上述反应分析推断后回答下列问题:
(5)
 的氧化性由强到弱依次是
的氧化性由强到弱依次是(6)在酸性溶液中存在大量的
 ,则
,则 中能与
中能与 大量共存的离子是
大量共存的离子是
您最近一年使用:0次



