解题方法
1 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)实验室制Cl2的反应中,浓盐酸所起的作用有_______ (填序号)。
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为_______ (用离子方程式表示,)。
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:
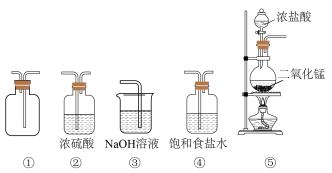
A.上述仪器的正确顺序(用序号表示):_______ ;
B.②装置中,浓硫酸的作用是_______ ;
C.⑤装置中发生反应的离子方程式为:_______ 。
(1)实验室制Cl2的反应中,浓盐酸所起的作用有
①氧化性 ②还原性 ③碱性 ④酸性
(2)“84消毒液”的有效成分是NaClO,可由Cl2与NaOH溶液反应得到,其离子方程式为
(3)在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图:

A.上述仪器的正确顺序(用序号表示):
B.②装置中,浓硫酸的作用是
C.⑤装置中发生反应的离子方程式为:
您最近一年使用:0次
2023-02-10更新
|
62次组卷
|
2卷引用:新疆可克达拉镇江高级中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
2 . 瑞典化学家舍勒是最早发现氯气的人,他在研究软锰矿矿石(主要成分是二氧化锰)时,把浓盐酸和软锰矿矿石混合加热,意外地得到了氯气。至今,实验室中还用这种方法制取氯气,装置如图所示,化学反应方程式为: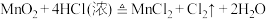
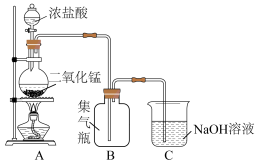
回答下列问题:
(1)实验室制取 的反应中,浓盐酸表现
的反应中,浓盐酸表现_________ (填“氧化性”、“还原性”或“酸性”)。
(2)请用单线桥表示该反应中电子转移的方向和数目_________ 。
(3)标况下,若生成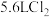 ,则转移电子的数目为
,则转移电子的数目为_________ 。
(4)装置C可吸收多余的 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式_________ 。所用 溶液一般为
溶液一般为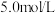 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、_________ 。
(5) 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是_________ 。
(6)装置C中也可能生成 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式_________ 。
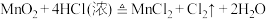

回答下列问题:
(1)实验室制取
 的反应中,浓盐酸表现
的反应中,浓盐酸表现(2)请用单线桥表示该反应中电子转移的方向和数目
(3)标况下,若生成
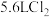 ,则转移电子的数目为
,则转移电子的数目为(4)装置C可吸收多余的
 ,生成
,生成 和
和 ,写出离子方程式
,写出离子方程式 溶液一般为
溶液一般为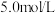 ,用
,用 固体配制
固体配制 该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、
该溶液,需要用到的仪器有托盘天平、烧杯、玻璃棒、胶头滴管、(5)
 有强氧化性,某实验小组为探究
有强氧化性,某实验小组为探究 、
、 、
、 在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下
在酸性条件下的氧化性强弱,设计实验如下:实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;实验②:向实验①的溶液中加入少量亚硫酸钠溶液,蓝色又褪去。以上实验说明,在酸性条件下 、
、 、
、 的氧化性由弱到强的顺序是
的氧化性由弱到强的顺序是(6)装置C中也可能生成
 ,
, 和浓盐酸也可以制备
和浓盐酸也可以制备 ,试写出离子方程式
,试写出离子方程式
您最近一年使用:0次
解题方法
3 . 某化学兴趣小组同学利用以下装置制取纯净、干燥的 并探究
并探究 及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
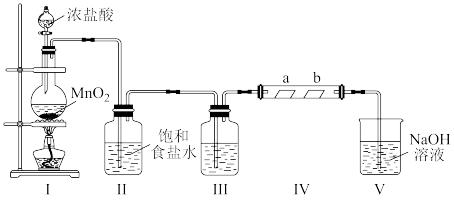
(1)装置Ⅰ可用于制取 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(2)装置Ⅱ的作用是_______ ;装置Ⅲ中的试剂名称为_______ 。
(3)装置Ⅳ中a处红色纸条_______ (填“无明显变化”或“褪色”,下同),b处红色纸条_______ 。
(4)装置Ⅴ中 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式_______ 。
(5)为探究装置Ⅴ中所得的漂白液的漂白效果和氧化性,某化学小组设计如下实验。
查阅资料可知:
ⅰ. 溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
ⅱ.溶液的 会影响
会影响 溶液的漂白效果。
溶液的漂白效果。
具体实验操作如下:
①漂白液的有效成分是 而不是
而不是 ,因为
,因为 不稳定,不易保存。写出
不稳定,不易保存。写出 见光分解的化学方程式
见光分解的化学方程式_______ 。
②实验Ⅲ中产生的气体是 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
③对比实验Ⅱ和Ⅲ,溶液的
_______ (填“升高”或“降低”)会提高 的氧化性。
的氧化性。
 并探究
并探究 及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
及其化合物的漂白作用(Ⅳ中夹持装置已略去,a为干燥的红色纸条,b为湿润的红色纸条)。
(1)装置Ⅰ可用于制取
 ,写出该反应的化学方程式
,写出该反应的化学方程式(2)装置Ⅱ的作用是
(3)装置Ⅳ中a处红色纸条
(4)装置Ⅴ中
 溶液可吸收
溶液可吸收 并制得漂白液,写出该反应的离子方程式
并制得漂白液,写出该反应的离子方程式(5)为探究装置Ⅴ中所得的漂白液的漂白效果和氧化性,某化学小组设计如下实验。
查阅资料可知:
ⅰ.
 溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;
溶液具有氧化性,能使紫色石蕊试液先变蓝后褪色;ⅱ.溶液的
 会影响
会影响 溶液的漂白效果。
溶液的漂白效果。具体实验操作如下:
| 实验操作 | 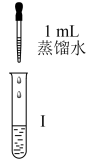 漂白液+石蕊试液 | 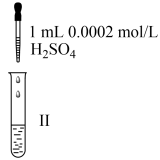 漂白液+石蕊试液 |  漂白液+石蕊试液 |
| 实验现象 | 混合后溶液的 短时间内未褪色,一段时间后蓝色褪去 短时间内未褪色,一段时间后蓝色褪去 | 混合后溶液 ,蓝色迅速褪去,无气体产生 ,蓝色迅速褪去,无气体产生 | 混合后溶液 ,蓝色迅速褪去,并产生大量气体,使湿润的淀粉 ,蓝色迅速褪去,并产生大量气体,使湿润的淀粉 试纸变蓝 试纸变蓝 |
 而不是
而不是 ,因为
,因为 不稳定,不易保存。写出
不稳定,不易保存。写出 见光分解的化学方程式
见光分解的化学方程式②实验Ⅲ中产生的气体是
 ,发生反应的离子方程式为
,发生反应的离子方程式为③对比实验Ⅱ和Ⅲ,溶液的

 的氧化性。
的氧化性。
您最近一年使用:0次
2022-01-11更新
|
165次组卷
|
2卷引用:河北省邯郸市2021-2022学年高一上学期期末考试化学试题
4 . 工业上以晒盐后的卤水为原料进行提溴,主要流程如下:
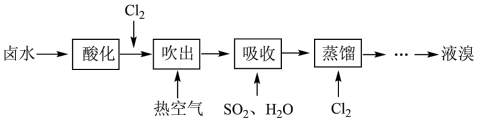
(1)卤水呈碱性,在通入Cl2先需先酸化,原因是___________ 。
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为___________ 。
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是___________ 。
②由该反应可知关于物质氧化性和还原性比较正确的是___________ 。
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是___________ 。
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是___________ 。
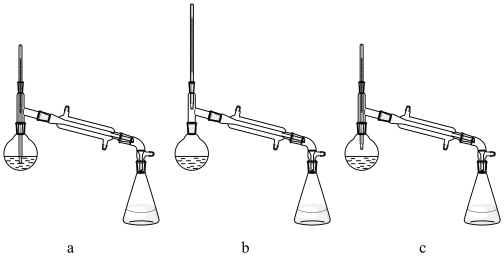
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是___________ 。
(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是___________ mmol/L (毫摩尔/L)。

(1)卤水呈碱性,在通入Cl2先需先酸化,原因是
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是
②由该反应可知关于物质氧化性和还原性比较正确的是
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是

(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是
您最近一年使用:0次
5 . 资料:“84”消毒液中含氯微粒主要有ClO-、Cl-、HClO,相同浓度时,HClO的氧化性强于ClO-。通常情况下,应将“84”消毒液原液稀释后使用,一般不用于衣服等纺织品的洗涤消毒。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为_______ 。
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
①该“84”消毒液的物质的量浓度为_______ mol/L。
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为_______ mL。
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是_______ 。
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
①实验1中NaClO溶液与空气中二氧化碳反应的离子方程式为_______ 。(已知酸性: )
)
②实验3中生成气体的离子方程式为_______ 。
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是_______ 。
(1)常温,将氯气通入NaOH溶液中可制得“84”消毒液,该反应的化学方程式为
(2)已知某“84”消毒液瓶体部分标签如图所示,请回答下列问题。
| “84”消毒液 有效成分:NaClO 规格:1000 mL 质量分数:25% 密度:1.192g/cm3 |
②“84”消毒液使用时需要稀释,某小组用上述“84”消毒液配制500 mL 0.2mol/L的稀溶液,需要用量筒量取该“84”消毒液体积为
③配制过程中,下列操作会造成新配制的稀溶液浓度偏低的是
A.容量瓶使用时未干燥 B.没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线 D.定容后液面低于刻度线,再加蒸馏水至刻度线
(3)为研究“84”消毒液的性质与使用条件,进行下列实验:
向三支试管中分别加入2 mL“84”消毒液和5滴紫色石蕊。继续进行如下实验:
| 实验 | 操作 | 现象 |
| 实验1 | 加入2 mL蒸馏水 | 短时间内未褪色,一段时间后蓝色褪去 |
| 实验2 | 加入2 mL 0.0002 mol/L的H2SO4溶液 | 蓝色迅速褪去,无气体产生 |
| 实验3 | 加入2 mL 2 mol/L的H2SO4溶液 | 蓝色迅速褪去,并产生大量刺激性的气体 |
 )
)②实验3中生成气体的离子方程式为
③综合以上实验为提高单位时间内“84”消毒液的漂白效果,你的建议是
您最近一年使用:0次
解题方法
6 . 实验室要制取一瓶纯净干燥的氯气。现有如图所示仪器和药品可供使用:

(1)实验室制取氯气的原理:
其中HCl所表现的性质是
(2)接上述仪器的正确顺序是 。
| A.ABCEFGHD | B.ABCFEGHD | C.AFEBCGHD | D.AFEBCHGD |
A.除去氯气中的水蒸气 B.除去氯气中的氯化氢
C.尾气吸收 D.收集氯气
您最近一年使用:0次
2022-12-07更新
|
329次组卷
|
2卷引用:黑龙江省海林林业局第一中学2021-2022学年高一上学期第二次月考化学试题
7 . 某研究性学习小组在实验室制取纯净的氯气,设计实验装置如图所示。

回答下列问题:
(1)写出A中发生反应的化学方程式是________ ,该反应体现了浓盐酸的酸性和________ 性。
(2)B中饱和食盐水的作用是________ 。
(3)E中NaOH溶液的作用是除去剩余氯气,防止污染空气。写出该反应的离子方程式________ 。
(4)该组同学将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色褪去。
①预测红色褪去的原因:甲同学认为可能是氯水中的酸与NaOH发生中和反应所致,乙同学认为可能是氯水中________ (填化学式)的强氧化性所致。
②设计实验证明红色褪色的原因:取褪色后的溶液于试管中,加入________ ,若观察到________ ,证明________ 同学的观点是正确。

回答下列问题:
(1)写出A中发生反应的化学方程式是
(2)B中饱和食盐水的作用是
(3)E中NaOH溶液的作用是除去剩余氯气,防止污染空气。写出该反应的离子方程式
(4)该组同学将新制的饱和氯水慢慢滴入含有酚酞的NaOH溶液中,当滴到一定量时,红色褪去。
①预测红色褪去的原因:甲同学认为可能是氯水中的酸与NaOH发生中和反应所致,乙同学认为可能是氯水中
②设计实验证明红色褪色的原因:取褪色后的溶液于试管中,加入
您最近一年使用:0次
解题方法
8 . 下图是实验室制备 的实验装置图,其中甲为氯气的发生装置,丙装置中反应的离子方程式为
的实验装置图,其中甲为氯气的发生装置,丙装置中反应的离子方程式为 (未配平)。(资料:
(未配平)。(资料: 为紫色固体,微溶于
为紫色固体,微溶于 ,在碱性环境中稳定,具有强氧化性)下列说法不正确的是
,在碱性环境中稳定,具有强氧化性)下列说法不正确的是

 的实验装置图,其中甲为氯气的发生装置,丙装置中反应的离子方程式为
的实验装置图,其中甲为氯气的发生装置,丙装置中反应的离子方程式为 (未配平)。(资料:
(未配平)。(资料: 为紫色固体,微溶于
为紫色固体,微溶于 ,在碱性环境中稳定,具有强氧化性)下列说法不正确的是
,在碱性环境中稳定,具有强氧化性)下列说法不正确的是
A.B装置的作用是干燥水,所用试剂为浓 |
| B.工业上利用D中所发生的反应原理制备漂白液 |
| C.三颈烧瓶中使用搅拌器的目的是加快反应速率,增大反应物的利用率 |
D.A中浓盐酸中的 在该反应中既失电子又为反应提供所需的酸性环境 在该反应中既失电子又为反应提供所需的酸性环境 |
您最近一年使用:0次
9 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
(1)阅读资料,回答下列相关问题。

①资料涉及的物质中,属于碱的是____ (填化学式);属于盐的是____ (填化学式)。
②Cl2与NaOH溶液反应的离子方程式是____ 。
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律: + = + (填物质类别 )____ 。
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是____ 。。
②若反应中生成了0.01molCl2,转移电子的物质的量为____ mol。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO____ H2O2的(填“>”或“<”)。
(1)阅读资料,回答下列相关问题。

①资料涉及的物质中,属于碱的是
②Cl2与NaOH溶液反应的离子方程式是
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律: + = + (
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是
②若反应中生成了0.01molCl2,转移电子的物质的量为
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO
您最近一年使用:0次
名校
10 . 氯气是一种重要的化工原材料,常用于制备盐酸、漂白液、农药和药品等。某小组为了制备源白液(主要成分 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: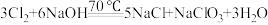
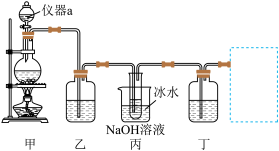
(1)仪器a的名称是___________ ,写出装置甲中发生的化学反应方程式___________ 。
(2)装置乙的作用是提纯 ,装有的试剂是
,装有的试剂是___________ ,装置乙不能省去,原因是___________ 。
(3)丙中冰水浴的作用是___________ 。
(4)欲验证 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是___________ ,现象是___________ 。
(5)在虚线框中可以使用下列的装置是___________
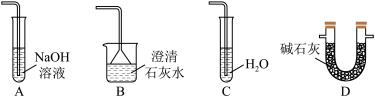
(6)常温下,在 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平___________ 。在该反应中,表现酸性和还原性的 质量比是
质量比是___________ 。
 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: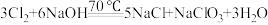

(1)仪器a的名称是
(2)装置乙的作用是提纯
 ,装有的试剂是
,装有的试剂是(3)丙中冰水浴的作用是
(4)欲验证
 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是(5)在虚线框中可以使用下列的装置是

(6)常温下,在
 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平 质量比是
质量比是
您最近一年使用:0次



