名校
解题方法
1 . 膨松剂在面包制作过程中发生反应产生气体,使面包变得松软。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,化学兴趣小组对该膨松剂进行如下探究:
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:
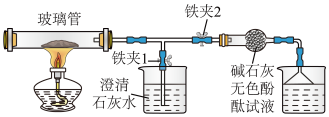
(1)关闭铁夹2,打开铁夹1,观察到现象:___________ ,说明产物中有二氧化碳;
(2)打开铁夹2,关闭铁夹1,观察到的现象:___________ ,说明产物中有氨气;
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是___________ (化学式)。
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)
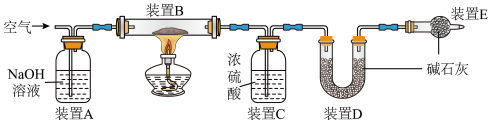
(4)将8g膨松剂装入装置B中,通过测定实验前后装置___________ (填字母序号)的质量,其质量差即为样品产生的二氧化碳气体的质量。加热前,先对已连接好的装置A、B和C通一段时间的空气,再连接上装置D、E;加热过程中,装置C的作用是___________ ;停止加热后,应继续通入空气一段时间的目的是___________ 。
(5)测定氨气的质量:将上图装置中___________ (填字母)的连接顺序对调。另取8g膨松剂装入装置B中,通过测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量。
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会___________ (填“偏大”、“不变”或“偏小”)
【查阅资料】:碱石灰不与氨气反应,常用于吸收水蒸气和二氧化碳;常用浓硫酸吸收氨气。
实验一:检验膨松剂成分
在玻璃管中加入该膨松剂,按下图连接好装置(铁架台略去,下同)。点燃酒精灯:

(1)关闭铁夹2,打开铁夹1,观察到现象:
(2)打开铁夹2,关闭铁夹1,观察到的现象:
(3)充分加热后,玻璃管中仍有固体,结论:该膨松剂的成分是
实验二:测定膨松剂受热产生气体的量
用下图装置测定该膨松剂样品产生的二氧化碳气体的质量(整套装置气密性良好,各装置中气体吸收剂足量)

(4)将8g膨松剂装入装置B中,通过测定实验前后装置
(5)测定氨气的质量:将上图装置中
【解释与结论】同学们进一步对实验结果进行分析后,认为该膨松剂质量良好。
【反思与评价】实验II中,若没有装置E,造成测定结果可能会
您最近一年使用:0次
2021-01-01更新
|
361次组卷
|
2卷引用:山东省青岛第五十八中学2020-2021学年高一上学期期中考试化学试题
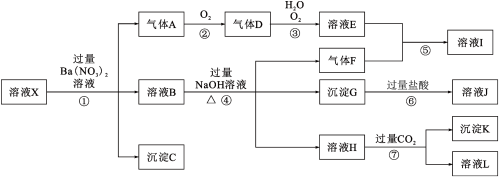
2 . 某强酸性溶液X,可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有_______ 。
(2)产生气体A的离子方程式为_______ 。
(3)在实验室中收集气体A,可选择如图装置中的_______ 。
A.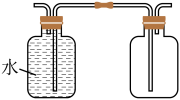 B.
B.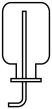 C.
C.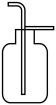 D.
D.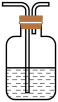
(4)写出④反应中生成溶液H的离子方程式_______ 。
(5)对不能确定是否存在的离子,请简述检测实验方案_______ 。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
中的一种或几种离子,取该溶液进行实验,其现象及转化如下图所示。
请回答下列问题:
(1)由整体的实验过程可判断溶液X中一定不存在的阴离子有
(2)产生气体A的离子方程式为
(3)在实验室中收集气体A,可选择如图装置中的
A.
 B.
B. C.
C. D.
D.
(4)写出④反应中生成溶液H的离子方程式
(5)对不能确定是否存在的离子,请简述检测实验方案
您最近一年使用:0次
名校
3 . 实验室制备 溶液并用于处理含氨氮废水。
溶液并用于处理含氨氮废水。
I:低温下将 通入
通入 溶液中制得
溶液中制得 溶液,装置如图所示。
溶液,装置如图所示。
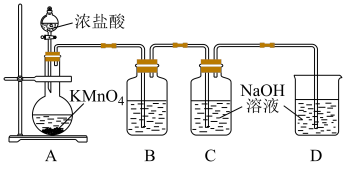
(1)装置B中盛放的试剂是___________ 。
(2)写出C装置中发生的化学方程式:___________ ,为了防止装置C温度升高生成副产物 ,可采取的操作为
,可采取的操作为___________ 。
II: 溶液处理含氨氮废水(
溶液处理含氨氮废水( 为
为 ),氨氮废水中的氮元素多以和
),氨氮废水中的氮元素多以和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:

已知:达标废水中氯元素主要以 形式存在。
形式存在。
(3)过程I的目的是将 转化为
转化为 ,并通过鼓入大显空气将氨气吹出,写出
,并通过鼓入大显空气将氨气吹出,写出 转化为
转化为 的离子方程式:
的离子方程式:___________ 。
(4)过程II加入 溶液可将废水中的
溶液可将废水中的 转化为无毒物质,写出反应的离子方程式:
转化为无毒物质,写出反应的离子方程式:___________ 。
(5)含余氯废水的主要成分是 以及
以及 ,X可选用以下哪种物质以达到去除余氯的目的
,X可选用以下哪种物质以达到去除余氯的目的___________ (填字母),
a. b.
b. c.
c. d.
d.
写出其中一个反应的离子方程式:___________ 。
 溶液并用于处理含氨氮废水。
溶液并用于处理含氨氮废水。I:低温下将
 通入
通入 溶液中制得
溶液中制得 溶液,装置如图所示。
溶液,装置如图所示。
(1)装置B中盛放的试剂是
(2)写出C装置中发生的化学方程式:
 ,可采取的操作为
,可采取的操作为II:
 溶液处理含氨氮废水(
溶液处理含氨氮废水( 为
为 ),氨氮废水中的氮元素多以和
),氨氮废水中的氮元素多以和 的形式存在。某工厂处理氨氮废水的流程如下:
的形式存在。某工厂处理氨氮废水的流程如下:
已知:达标废水中氯元素主要以
 形式存在。
形式存在。(3)过程I的目的是将
 转化为
转化为 ,并通过鼓入大显空气将氨气吹出,写出
,并通过鼓入大显空气将氨气吹出,写出 转化为
转化为 的离子方程式:
的离子方程式:(4)过程II加入
 溶液可将废水中的
溶液可将废水中的 转化为无毒物质,写出反应的离子方程式:
转化为无毒物质,写出反应的离子方程式:(5)含余氯废水的主要成分是
 以及
以及 ,X可选用以下哪种物质以达到去除余氯的目的
,X可选用以下哪种物质以达到去除余氯的目的a.
 b.
b. c.
c. d.
d.
写出其中一个反应的离子方程式:
您最近一年使用:0次
4 . Ⅰ.明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
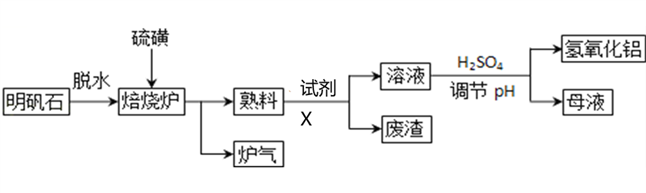
(1)焙烧炉中Al2(SO4)3与硫磺反应生成一种能使品红溶液褪色的物质和一种具有两性的物质,写出该反应化学方程式______________________________________________________ 。
(2)试剂X最好为下列试剂中的_________
A.NaOH B.CO2 C.盐酸 D.氨水
熟料溶解时,发生反应的离子方程式为_____________________________________ 。
(3)母液中溶质主要成分的化学式为__________ 。溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_______________________________________________ 。
Ⅱ. 有100ml某透明溶液,可能含有以下离子中的若干种:Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.6mol淡黄色粉末时,共收集到0.8mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.65mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(4)淡黄色粉末为_________________ ;
(5)溶液中肯定有__________________ 离子;
(6)溶液中阳离子按量由少到多其物质的量之比为______________ (H+及没有确定的离子除外)。

(1)焙烧炉中Al2(SO4)3与硫磺反应生成一种能使品红溶液褪色的物质和一种具有两性的物质,写出该反应化学方程式
(2)试剂X最好为下列试剂中的
A.NaOH B.CO2 C.盐酸 D.氨水
熟料溶解时,发生反应的离子方程式为
(3)母液中溶质主要成分的化学式为
Ⅱ. 有100ml某透明溶液,可能含有以下离子中的若干种:Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.6mol淡黄色粉末时,共收集到0.8mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.65mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(4)淡黄色粉末为
(5)溶液中肯定有
(6)溶液中阳离子按量由少到多其物质的量之比为
您最近一年使用:0次
名校
解题方法
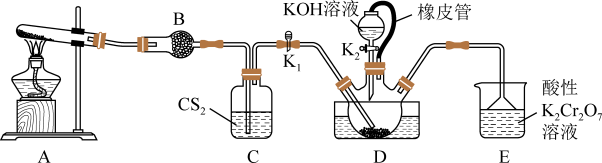
5 . 硫氰化钾(KSCN)是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某实验小组用下图所示的装置制备硫化钾。
(1)制备NH4SCN溶液:三颈烧瓶D内盛放有CS2、水和催化剂,实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至CS2消失,反应的方程式为: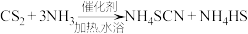 。
。
①写出A装置生成氨气的化学方程式___________
②仪器B的名称是:___________ 。
③装置C的作用是:___________ 。
④三颈烧瓶左侧导管口必须插入到下层的CS2液体中,主要原因是___________ (写出一条原因即可)。
(2)制备KSCN溶液:
熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,NH4SCN完全分解后(反应方程式为 ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为___________ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(1)制备NH4SCN溶液:三颈烧瓶D内盛放有CS2、水和催化剂,实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的氨气缓缓通入到三颈烧瓶中,反应至CS2消失,反应的方程式为:
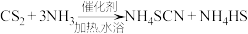 。
。①写出A装置生成氨气的化学方程式
②仪器B的名称是:
③装置C的作用是:
④三颈烧瓶左侧导管口必须插入到下层的CS2液体中,主要原因是
(2)制备KSCN溶液:
熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,NH4SCN完全分解后(反应方程式为
 ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。反应的化学方程式为(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
您最近一年使用:0次
2022-05-20更新
|
218次组卷
|
2卷引用:广东省广州市育才中学2021-2022学年高一下学期期中考试化学试题
名校
6 . 下列实验能够达到目的的是


| A.装置甲可以制取少量氧气 | B.装置乙用来检验 |
| C.装置丙用来验证碳酸氢钠受热分解 | D.装置丁制备无水氯化镁 |
您最近一年使用:0次
2021-04-19更新
|
303次组卷
|
3卷引用:辽宁省“决胜新高考·名校交流“2021届高三3月联考化学试题
辽宁省“决胜新高考·名校交流“2021届高三3月联考化学试题(已下线)2021年高考化学押题预测卷(湖北卷)01(含考试版、答题卡、参考答案、全解全析)新疆师范大学附属中学2021-2022学年高三9月月考化学试题
解题方法
7 . 硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如图所示:
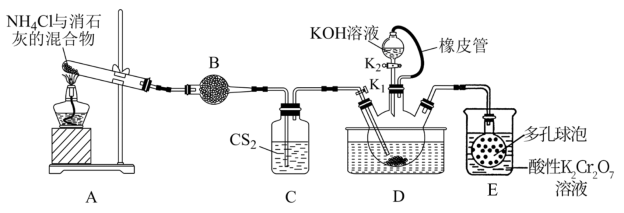
已知:① 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
(1)制备 溶液:实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
溶液:实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的气体缓缓通入D中,发生反应 ,该反应比较缓慢,反应至
,该反应比较缓慢,反应至 消失。
消失。
①装置A中反应方程式为:___________ 。
②三颈烧瓶的下层CS2液体必须漫没导气管口,主要原因是___________ 。
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,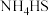 完全分解后(
完全分解后( ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为___________ 。装置D中橡皮管的作用是___________ 。
②装置E的作用除可以吸收NH3外,还能吸收产生的___________ 。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品,配成100mL溶液。量取20.0mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液20.00mL。滴定时发生的反应:
标准溶液20.00mL。滴定时发生的反应: (白色)。则判断到达滴定终点时溶液颜色的变化为
(白色)。则判断到达滴定终点时溶液颜色的变化为___________ 。

已知:①
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
(1)制备
 溶液:实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
溶液:实验开始时,打开K1,(K2处于关闭状态)加热装置A、D,使A中产生的气体缓缓通入D中,发生反应 ,该反应比较缓慢,反应至
,该反应比较缓慢,反应至 消失。
消失。①装置A中反应方程式为:
②三颈烧瓶的下层CS2液体必须漫没导气管口,主要原因是
(2)制备KSCN溶液:
①熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,
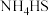 完全分解后(
完全分解后( ),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
),打开K2,继续保持溶液温度为105℃,缓缓滴入适量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为②装置E的作用除可以吸收NH3外,还能吸收产生的
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩、
(4)测定晶体中KSCN的含量:称取10.0g样品,配成100mL溶液。量取20.0mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液20.00mL。滴定时发生的反应:
标准溶液20.00mL。滴定时发生的反应: (白色)。则判断到达滴定终点时溶液颜色的变化为
(白色)。则判断到达滴定终点时溶液颜色的变化为
您最近一年使用:0次
名校
解题方法
8 . 下列有关氨和铵盐说法正确的是( )
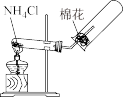
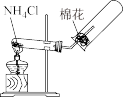
A.氨和铵盐都易溶于水,都能生成NH |
| B.铵盐都能与碱反应,不能与酸反应 |
| C.实验室制备氨气可用如图所示试剂和装置 |
| D.铵盐受热分解都能产生氨气 |
您最近一年使用:0次



