名校
解题方法
1 . 氮是自然界中各种生物体生命活动不可缺少的重要元素,研究氮的循环和转化对生产、生活有重要的价值。
I.某工厂用氨制硝酸和铵盐的流程如图1所示。

(1)设备1中发生反应的化学方程式是___________ 。
(2)在工业上,可用浓氨水检验输送氯气的管道是否漏气,若漏气则有白烟生成,写出反应的化学方程式___________ 。同温同压下,理论上设备1与设备2中消耗空气的体积比为___________ 。
II.氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氮元素多以 和
和 的形式存在。某工厂处理氨氮废水的流程如图2所示:
的形式存在。某工厂处理氨氮废水的流程如图2所示:
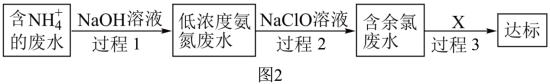
(3)过程1加NaOH的同时还需要鼓入大量空气,目的是___________ 。
(4)过程2的产物均为无毒物质,反应后含氮元素、氯元素的产物化学式分别为___________ 。
(5)含余氯废水的主要成分是NaClO以及HClO。X可选用___________(填序号)
I.某工厂用氨制硝酸和铵盐的流程如图1所示。

(1)设备1中发生反应的化学方程式是
(2)在工业上,可用浓氨水检验输送氯气的管道是否漏气,若漏气则有白烟生成,写出反应的化学方程式
II.氨氮废水的处理是当前科学研究的热点问题。氨氮废水中的氮元素多以
 和
和 的形式存在。某工厂处理氨氮废水的流程如图2所示:
的形式存在。某工厂处理氨氮废水的流程如图2所示:
(3)过程1加NaOH的同时还需要鼓入大量空气,目的是
(4)过程2的产物均为无毒物质,反应后含氮元素、氯元素的产物化学式分别为
(5)含余氯废水的主要成分是NaClO以及HClO。X可选用___________(填序号)
| A.KOH | B. | C. | D.Na2SO4 |
您最近一年使用:0次
名校
解题方法
2 . 某强酸性透明溶液中可能含有 、
、 、
、 、
、 、
、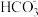 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:
①取该溶液 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下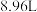 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到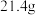 固体。
固体。
②向上述滤液中加入足量的 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。
已知:含 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。
(1)该溶液中一定含有___________ ;可能含有___________ ,可以用定性分析操作___________ 来进行检验。若含有,现象是:___________ 。
(2)计算:该 溶液中,若
溶液中,若 ,则
,则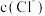
___________ 。
(3)已知 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式___________ ;当某溶液 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有___________ 。
a.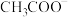 b.
b.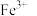 c.
c. d.
d. e.
e.
 、
、 、
、 、
、 、
、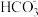 、
、 中的几种。为了确定其组成,现做以下实验:
中的几种。为了确定其组成,现做以下实验:①取该溶液
 ,加入足量的
,加入足量的 溶液,加热,得到标况下
溶液,加热,得到标况下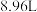 气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到
气体;同时产生红褐色沉淀,过滤,洗涤,干燥得到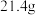 固体。
固体。②向上述滤液中加入足量的
 溶液,产生白色沉淀,过滤,洗涤,干燥得到
溶液,产生白色沉淀,过滤,洗涤,干燥得到 固体。
固体。已知:含
 的盐与强碱混合后,加热可以产生
的盐与强碱混合后,加热可以产生 。
。(1)该溶液中一定含有
(2)计算:该
 溶液中,若
溶液中,若 ,则
,则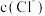
(3)已知
 与
与 在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式
在溶液中“相遇”时会产生红褐色沉淀和无色气泡,写出相应的离子方程式 中大量存在
中大量存在 时,
时, 溶液中不可能大量含有
溶液中不可能大量含有a.
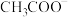 b.
b. c.
c. d.
d. e.
e.
您最近一年使用:0次
2021-11-21更新
|
263次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2021-2022学年高一上学期期中联考化学试题
解题方法
3 . 图表示有关的一种反应物或生成物(无关物质已略去),其中W为铵盐,A为无色有刺激性气味的气体,C为无色气体,请填写下列空白。
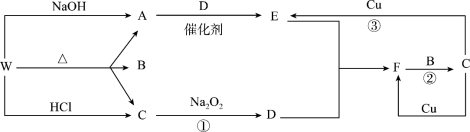
(1)W是__________ ,F是___________ (请填写化学式)。
(2)反应①中若消耗Na2O2 7.8 g,则转移的电子数为___________ 。
(3)反应③的离子方程式___________ ,此反应氧化剂和还原剂物质的量比为___________ 。
(4)A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式____________ 。

(1)W是
(2)反应①中若消耗Na2O2 7.8 g,则转移的电子数为
(3)反应③的离子方程式
(4)A与CuO在加热条件下能反应生成N2和Cu,请写出该反应的化学方程式
您最近一年使用:0次
2020-11-06更新
|
263次组卷
|
3卷引用:湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题
湖北省竹山县第二中学2021-2022学年高一下学期第一次月考化学试题广东省潮州市潮安区2019-2020学年高一上学期期中考试化学试题(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
解题方法
4 . 工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数。已知①Al4C3与硫酸反应可生成CH4;②AlN溶于强酸产生铵盐,溶于强碱生成氨气(忽略NH3在强碱性溶液中的溶解);③该实验条件下的气体摩尔体积为VmL/mol,实验装置如下(量气管为碱式滴定管改装)
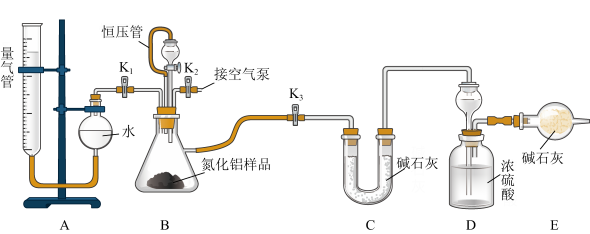
实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。
(1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞______ ,打开活塞______ 。
②当_____ 时,说明反应已经结束。读取读数之前,应对量气管进行的操作为____________ ;若量气管中的液面高于右侧球形容器中的液面,所测气体体积______ (填“偏大”、“偏小”或“无影响”)。
③记录滴定管的读数为y mL,则Al4C3的质量分数为_________ (用可能含a、b、x、y、Vm的代数式表示)。
④若无恒压管,对所测Al4C3质量分数的影响是______ (填“偏大”、“偏小”或“无影响”)。
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为__________ ;反应完成后,__________ (填该步应进行的操作),最后称得装置D的质量为cg,进而测量AlN的质量分数。

实验过程:连好装置后,检验装置的气密性;称得装置D的初始质量为ag;称取bg AlN样品置于装置B的锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管中液面的初始读数为x mL(量气装置左右液面相平)。
(1)①若先测量Al4C3质量分数,对K1、K2、K3三个活塞的操作是关闭活塞
②当
③记录滴定管的读数为y mL,则Al4C3的质量分数为
④若无恒压管,对所测Al4C3质量分数的影响是
(2)若先测量AlN质量分数:首先关闭活塞K1,打开活塞K3,通过分液漏斗加入过量的某物质,写出AlN与过量的某物质发生反应的离子方程式为
您最近一年使用:0次
解题方法
5 . 某无色透明溶液中可能含有以下离子中的几种:Na+、K+、NH4+、Ag+、Mg2+、Cu2+、Cl-、CO32-、SO42-且所含的各离子物质的量浓度相等;取三份进行如下实验:
①向第一份中加入足量BaCl2溶液,得到白色沉淀,过滤后用盐酸洗涤沉淀,结果沉淀消失
②向第二份加入足量硝酸酸化的AgNO3溶液,溶液出现白色沉淀
③向第三份加入足量NaOH溶液并加热,收集到一定体积的气体,但溶液依然澄清
试回答下列问题:
(1)肯定存在的离子有______________________
(2)写出①中发生的离子反应方程式________________ ,___________________
(3)写出②中发生的离子反应方程式________________ ,___________________
(4)写出③中发生的离子反应方程式_________________________
①向第一份中加入足量BaCl2溶液,得到白色沉淀,过滤后用盐酸洗涤沉淀,结果沉淀消失
②向第二份加入足量硝酸酸化的AgNO3溶液,溶液出现白色沉淀
③向第三份加入足量NaOH溶液并加热,收集到一定体积的气体,但溶液依然澄清
试回答下列问题:
(1)肯定存在的离子有
(2)写出①中发生的离子反应方程式
(3)写出②中发生的离子反应方程式
(4)写出③中发生的离子反应方程式
您最近一年使用:0次
解题方法
6 . 某混合溶液中可能大量含有的离子如下表所示:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
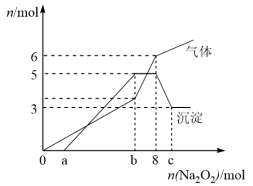
(1)该溶液中一定含有的阳离子是________________________________ ,其对应物质的量浓度之比为 ____________ ,溶液中一定不存在的阴离子是_______________________ 。
(2)写出沉淀减少的离子方程式________________________________________________ 。
| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | Cl-、OH-、CO32-、AlO2- |

(1)该溶液中一定含有的阳离子是
(2)写出沉淀减少的离子方程式
您最近一年使用:0次
解题方法
7 . 向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答:
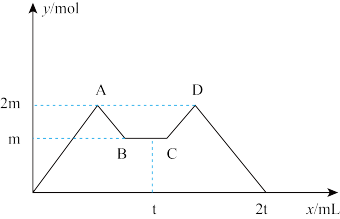
(1)AB段所表示的反应的离子方程式是________________________________________________ ;
CD段所表示的反应的离子方程式是_____________________________________ 。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是________________________ 。
(3)a是______________ ,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
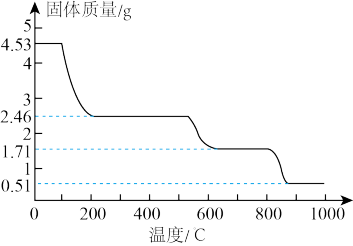
试通过计算确定400℃剩余固体成分的化学式_____________________________ 。(写出计算过程)

(1)AB段所表示的反应的离子方程式是
CD段所表示的反应的离子方程式是
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是
(3)a是
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。

试通过计算确定400℃剩余固体成分的化学式
您最近一年使用:0次



