解题方法
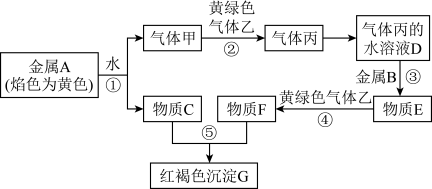
1 . 现有金属单质 A、B 和气体甲、乙、丙及物质 C、D、E、F、G,它们之间能发生如图反应(图中某些反应的产物及条件没有全部标出)。___________ ,氧化产物和还原产物的物质的量之比为 ___________ 。
(2)写出反应④的离子方程式___________ ,该反应证明 E 中的阳离子有___________ (填“氧化性”或“还原性”)。
(3)F 溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式___________ 。腐蚀结束后,通过以下两步可分离出铜,并实现 F 溶液再生:“试剂 a”和“操作”分别为 ___________ 、___________ 。
(2)写出反应④的离子方程式
(3)F 溶液常用于腐蚀覆铜印刷电路板,请写出相关的离子方程式

您最近一年使用:0次
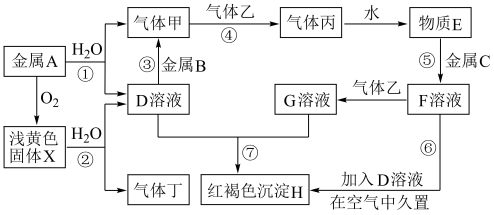
2 . 现有中学化学常见的金属单质A、B、C和气体甲、乙、丙、丁以及物质D、E、F、G、H、X,其中气体乙为黄绿色气体,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。
请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:___________ 。
(2)写出反应②的化学方程式:___________ ,该反应的氧化剂是_____ 。
(3)写出反应③的化学方程式:___________ 。
(4)写出反应⑥的化学方程式:___________ 。

请根据以上信息完成下列各题:
(1)写出反应①的离子方程式:
(2)写出反应②的化学方程式:
(3)写出反应③的化学方程式:
(4)写出反应⑥的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3) 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为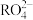 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解: 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为___________ 。
(6)高铁酸钠( )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。
①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:________

②每转移3mol电子,生成 的物质的量为
的物质的量为___________ mol。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)
 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为(4)
 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为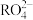 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:
 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为(6)高铁酸钠(
 )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:

②每转移3mol电子,生成
 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-29更新
|
328次组卷
|
2卷引用:河北省秦皇岛市第一中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
4 . Ⅰ.汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法”。通过这种方法,他制备得到了金属钾和钠。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:___________ 。
(2)关于金属钠,下列叙述正确的是___________
(3)钠在空气中燃烧产物的颜色是___________ , 电子式为___________ 。
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是___________ 。
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):
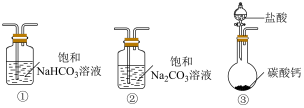
选取必要的实验装置,正确的连接顺序为___________ (填序号)。
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
此实验说明甲方案___________ (填“可行”或“不可行”)。
(7)产生浑浊(伴有气体产生)的离子方程式:___________ 。
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是___________ (填化学式)。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:
(2)关于金属钠,下列叙述正确的是___________
| A.钠可保存在煤油或CCl4等液态有机物中 |
| B.氯化钠在电流作用下电离出的钠离子和氯离子 |
| C.钠与硫在常温下化合就能剧烈反应,甚至发生爆炸 |
| D.若金属钠着火,可采用干粉灭火器灭火 |
(3)钠在空气中燃烧产物的颜色是
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):

选取必要的实验装置,正确的连接顺序为
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2溶液 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(7)产生浑浊(伴有气体产生)的离子方程式:
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是
您最近一年使用:0次
名校
解题方法
5 . 某化学实验小组发现镁和 溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
(1)写出钠与水反应的化学程式:___________ 。
Ⅰ.探究加快速率的粒子
(2)甲同学推测加快速率的粒子有两种:① 能加快化学反应速率。②
能加快化学反应速率。② 能加快化学反应速率。
能加快化学反应速率。
为验证猜想,进行了如下实验:
已知:Mg和 反应只能看到镁条表面有极微量气泡附着,生成的
反应只能看到镁条表面有极微量气泡附着,生成的 会附着在镁条表面阻碍反应进行:
会附着在镁条表面阻碍反应进行: 在中性或碱性条件下不与镁反应:
在中性或碱性条件下不与镁反应: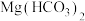 可溶于水。实验组1的目的是
可溶于水。实验组1的目的是___________ ;为了达到实验目的,实验组2应在1mol/L  溶液中
溶液中___________ 。根据以上实验,镁和 溶液反应比镁和水反应速率快的原因可能是
溶液反应比镁和水反应速率快的原因可能是___________ 。
Ⅱ.探究气体的成分
(3)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为___________ 。
(4)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是进行了如下实验,利用 传感器检测放出的气体中是否含有
传感器检测放出的气体中是否含有 。
。
得到如下曲线:
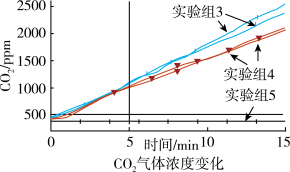
结论:
①通过上述实验,证明反应产生了 ;
;
②由图像可知,加入镁条后, 释放受到抑制,原因是:
释放受到抑制,原因是:___________ 。
(5)通过分析,镁和 溶液与
溶液与 的反应是因为
的反应是因为 发生了自偶电离:
发生了自偶电离: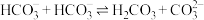 (
( 的
的 ,
, ),该反应的平衡常数是
),该反应的平衡常数是___________ (保留2位小数)。
 溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。(1)写出钠与水反应的化学程式:
Ⅰ.探究加快速率的粒子
(2)甲同学推测加快速率的粒子有两种:①
 能加快化学反应速率。②
能加快化学反应速率。② 能加快化学反应速率。
能加快化学反应速率。为验证猜想,进行了如下实验:
| 对照组 | 6mL 1molL 溶液( 溶液( ) ) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组1 | 6mL 1mol/L 溶液 溶液 | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mL 1mol/L 溶液 溶液 | 镁表面有极微量气泡附着 |
 反应只能看到镁条表面有极微量气泡附着,生成的
反应只能看到镁条表面有极微量气泡附着,生成的 会附着在镁条表面阻碍反应进行:
会附着在镁条表面阻碍反应进行: 在中性或碱性条件下不与镁反应:
在中性或碱性条件下不与镁反应: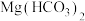 可溶于水。实验组1的目的是
可溶于水。实验组1的目的是 溶液中
溶液中 溶液反应比镁和水反应速率快的原因可能是
溶液反应比镁和水反应速率快的原因可能是Ⅱ.探究气体的成分
(3)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为
(4)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是进行了如下实验,利用
 传感器检测放出的气体中是否含有
传感器检测放出的气体中是否含有 。
。| 实验组3 | 取6mL 1mol/L  溶液加入250mL塑料瓶,塞紧 溶液加入250mL塑料瓶,塞紧 传感器,采集数据15min,记录液面上方 传感器,采集数据15min,记录液面上方 浓度的变化,重复实验2次。 浓度的变化,重复实验2次。 |
| 实验组4 | 取6mL 1mol/L  溶液、 溶液、 打磨好的镁条加入250mL塑料瓶,实验操作同上。 打磨好的镁条加入250mL塑料瓶,实验操作同上。 |
| 实验组5 | 用上述同样方法采集15min空塑料瓶中 浓度的数据。 浓度的数据。 |

结论:
①通过上述实验,证明反应产生了
 ;
;②由图像可知,加入镁条后,
 释放受到抑制,原因是:
释放受到抑制,原因是:(5)通过分析,镁和
 溶液与
溶液与 的反应是因为
的反应是因为 发生了自偶电离:
发生了自偶电离: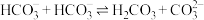 (
( 的
的 ,
, ),该反应的平衡常数是
),该反应的平衡常数是
您最近一年使用:0次
名校
解题方法
6 . 下列有关实验操作、实验现象及实验结论都正确的是
| 选项 | 实验操作 | 实验现象或结论 |
| A | 向CaCl2溶液中通入少量CO2 | 有白色沉淀生成,白色沉淀为CaCO3 |
| B | 向某溶液中滴加氯水,再滴加KSCN溶液 | 溶液变红色,原溶液中一定有Fe2+ |
| C | 把小块钠投入到滴有紫色石蕊试液的冷水中 | 钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变蓝 |
| D | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 | 鲜花褪色,证明氯气具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-11更新
|
890次组卷
|
2卷引用:广东省广州市南武中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 将总物质的量为nmol的钠和铝的混合物(其中钠的物质的量分数为x)投入到一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体VL。下列关系式正确的是( )
A.x=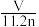 |
| B.0<x<0.5 |
| C.V=33.6n(1-x) |
| D.11.2n<V≤22.4n |
您最近一年使用:0次
2020-02-11更新
|
400次组卷
|
3卷引用:江西省鄱阳县第一中学2023届高三一模化学试题



