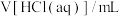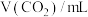名校
解题方法
1 . 下列实验方法中,不能 测定 和
和 的混合物中
的混合物中 质量分数的是
质量分数的是
 和
和 的混合物中
的混合物中 质量分数的是
质量分数的是| A.取a克混合物充分加热,剩余固体b克 |
| B.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加b克 |
| C.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧后,剩余固体b克 |
D.取a克混合物与足量 溶液充分反应,沉淀经过滤、洗涤、干燥,固体质量b克 溶液充分反应,沉淀经过滤、洗涤、干燥,固体质量b克 |
您最近一年使用:0次
名校
解题方法
2 . 食品工业经常使用 和
和 作膨松剂
作膨松剂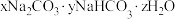 。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。 点溶液溶质的主要成分的化学式为
点溶液溶质的主要成分的化学式为___________ ;图中A点n(Na2CO3)=___________ mol。
(2)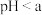 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为___________ 。x:y:z=___________ 。
 和
和 作膨松剂
作膨松剂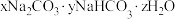 。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
。室温下,向含3.07g某膨松剂试样的溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。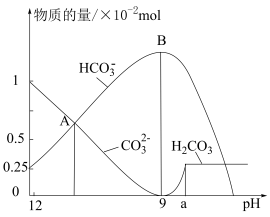
 点溶液溶质的主要成分的化学式为
点溶液溶质的主要成分的化学式为(2)
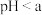 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为
您最近一年使用:0次
名校
解题方法
3 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)存贮时,Na应保存在___________ 中;实验室取用少量金属钠需要用到的实验用品有玻璃片、小刀、___________ 和___________ 等。
(2)工业上采用电解熔融NaCl(熔点为 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: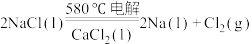 ,加入
,加入 的目的是
的目的是___________ (填序号)。
a.作催化剂,加块电解反应的速率
b.作还原剂,将 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。
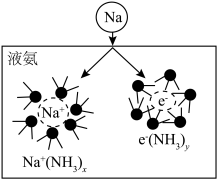
①生成的气体为___________ (填分子式)
②当 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过___________ 。(填序号)
a.无水 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液
(5)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为___________ g。
(6)为确定 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸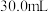 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:
①样品中物质的量之比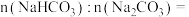
___________ 。
②稀盐酸的物质的量浓度
___________ mol/L。
(1)存贮时,Na应保存在
(2)工业上采用电解熔融NaCl(熔点为
 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: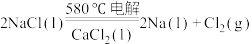 ,加入
,加入 的目的是
的目的是a.作催化剂,加块电解反应的速率
b.作还原剂,将
 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将
 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。

①生成的气体为
②当
 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过
a.无水
 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液(5)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为(6)为确定
 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸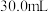 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
 体积(mL) 体积(mL) | 672 | 840 | 896 | 672 |
②稀盐酸的物质的量浓度

您最近一年使用:0次
名校
4 . 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是

①a点对应的溶液中:Na+、OH-、SO 、NO
、NO
②b点对应的溶液中:K+、Ca2+、NO 、Cl-
、Cl-
③c点对应的溶液中:Na+、Ca2+、NO 、Cl-
、Cl-
④d点对应的溶液中:F-、NO 、Fe2+、Ag+
、Fe2+、Ag+

①a点对应的溶液中:Na+、OH-、SO
 、NO
、NO
②b点对应的溶液中:K+、Ca2+、NO
 、Cl-
、Cl-③c点对应的溶液中:Na+、Ca2+、NO
 、Cl-
、Cl-④d点对应的溶液中:F-、NO
 、Fe2+、Ag+
、Fe2+、Ag+| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
名校
5 . 下列有关说法正确的是
| A.碳酸钠能与酸反应,不仅可用它来调节面团的酸度,还可用作膨松剂 |
| B.用活性炭漂白红墨水和用臭氧漂白纸浆,二者漂白原理相同 |
C.可以用84消毒液和淀粉检验加碘盐中添加的是碘化钾 还是碘酸钾 还是碘酸钾 |
D.向 还原 还原 得到的黑色固体中,先加入盐酸再加入 得到的黑色固体中,先加入盐酸再加入 溶液,溶液不显红色,说明黑色固体中无 溶液,溶液不显红色,说明黑色固体中无 |
您最近一年使用:0次
6 . 以下流程中涉及的物质均为中学化学常见物质,其中白色固体A为一种常见的钠盐,混合气体C可使澄清石灰水变浑浊,白色固体F在空气中易迅速变为灰绿色,黑色固体H有磁性。

请回答下列问题:
(1)白色固体E的化学式为___________ ;黑色固体H的化学式为___________ ;无色气体I的化学式为___________ 。
(2)无色混合气体C的组成为___________ 。
(3)白色固体A与少量澄清石灰水反应的离子方程式为___________ 。
(4)白色固体F无氧常温条件下分解的化学方程式为___________ 。
(5)请设计实验验证黑色固体H中金属元素的化合价___________ 。

请回答下列问题:
(1)白色固体E的化学式为
(2)无色混合气体C的组成为
(3)白色固体A与少量澄清石灰水反应的离子方程式为
(4)白色固体F无氧常温条件下分解的化学方程式为
(5)请设计实验验证黑色固体H中金属元素的化合价
您最近一年使用:0次
解题方法
7 . 课外兴趣小组的同学探究Na2CO3和NaHCO3的性质,并测定混合物中NaHCO3的含量。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_____________ 。
(2)该实验_____________ (填“能”或“不能”)说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是_____________ 。
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:_____________ 。
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定
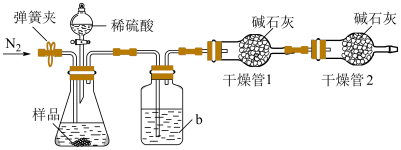
实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是_________________ (填名称)。
②第一次通入N2的目的是_________________ 。第二次通入N2的目的是_________________ 。如果没有进行第一次通N2的操作,测量的结果将会_________________ (填“偏大”“偏小”或“不变”)。
③计算出混合物中NaHCO3的质量分数为_________________ %(保留1位小数)。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
| 序号 | 实验操作 | 实验现象 | |
| ① | 在两支试管中分别加入1gNa2CO3、NaHCO3,再加入5mL水,充分振荡;用温度计测量两试管中溶液温度的变化 | Na2CO3 | NaHCO3 |
| 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 | ||
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液变微红 |
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是
(2)该实验
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
| 实验操作 | 实验数据 |
测量如下实验过程的pH变化 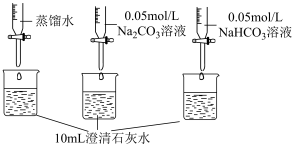 | 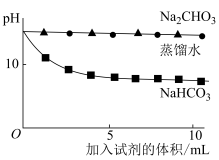 |
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定

实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是
②第一次通入N2的目的是
③计算出混合物中NaHCO3的质量分数为
您最近一年使用:0次
8 . 某干燥白色固体可能含有 、
、 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
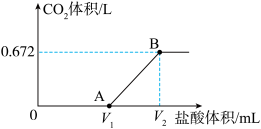
的盐酸,得到 体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
(1)产生的 的物质的量为
的物质的量为______________  ,
, 段反应的离子方程式为
段反应的离子方程式为____________________ 。
(2)若白色固体由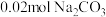 和
和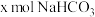 组成,则
组成,则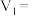
___________ ,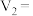
___________ 。
(3)若白色固体由 和
和 组成,
组成, ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为_______________________________ ,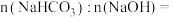
_________________ 。
(4)若白色固体只由 和
和 组成,且
组成,且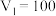 ,
, ,则
,则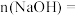
__________  ,原
,原 溶液中的
溶液中的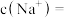
_______________  。
。
(5)另取某 和
和 组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸
组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸 ,充分反应,产生
,充分反应,产生 的体积如下表(标准状况下,且不考虑
的体积如下表(标准状况下,且不考虑 在水中的溶解):
在水中的溶解):
样品中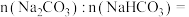
__________________ ,盐酸的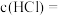
_______________  。
。
 、
、 、
、 中的几种,取一定质量的该固体加蒸馏水配制
中的几种,取一定质量的该固体加蒸馏水配制 溶液,并向该溶液中滴加
溶液,并向该溶液中滴加 的盐酸,得到
的盐酸,得到 体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
体积(标准状况下)与盐酸体积的关系如图所示。回答下列问题:
(1)产生的
 的物质的量为
的物质的量为 ,
, 段反应的离子方程式为
段反应的离子方程式为(2)若白色固体由
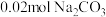 和
和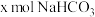 组成,则
组成,则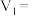
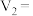
(3)若白色固体由
 和
和 组成,
组成, ,则
,则 与
与 溶于水后发生反应的离子方程式为
溶于水后发生反应的离子方程式为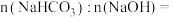
(4)若白色固体只由
 和
和 组成,且
组成,且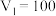 ,
, ,则
,则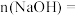
 ,原
,原 溶液中的
溶液中的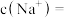
 。
。(5)另取某
 和
和 组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸
组成的混合物样品,称取3份该样品溶于水后分别逐滴加入相同浓度盐酸 ,充分反应,产生
,充分反应,产生 的体积如下表(标准状况下,且不考虑
的体积如下表(标准状况下,且不考虑 在水中的溶解):
在水中的溶解):实验序号 | ① | ② | ③ |
| 100.0 | 100.0 | 100.0 |
| 3.80 | 7.60 | 11.40 |
| 896 | 1344 | 896 |
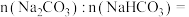
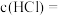
 。
。
您最近一年使用:0次
名校
9 . 有A、B两种常见化合物,其焰色试验均呈黄色,C是一种单质气体,相互转化关系如下图所示(部分生成物已略去)。回答下列问题:

(1)A的化学式为_______ ,用化学方程式表示A的用途_______ ,上述反应消耗2mol A时,制得气体的质量为_______ ,转移电子总数约为_______ 个。
(2)简述鉴别E与纯碱的一种方法_______ 。
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为_______ ,气体产物有_______ 。
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为_______ 或_______ 。

(1)A的化学式为
(2)简述鉴别E与纯碱的一种方法
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为
您最近一年使用:0次
名校
解题方法
10 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献.下图为联合制碱法的主要过程(部分物质已略去).下列说法不正确的是


A.沉淀池中有 析出,因为一定条件下 析出,因为一定条件下 的溶解度最小 的溶解度最小 |
B.滤液中主要含有 、 、 和 和 |
| C.设计循环的目的是提高原料的利用率 |
D.某纯碱样品中含杂质 ,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中 ,取质量为ag的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到bg固体物质,则此样品中 的质量分数为106(b-a)/a 的质量分数为106(b-a)/a |
您最近一年使用:0次