20-21高一下·浙江·阶段练习
名校
1 . 实验室中有一瓶碳酸氢钠固体,因受热而部分变质(杂质为Na2CO3,假设杂质分布均匀)。为测定其组成,称取1.892g样品溶于水,配成500mL溶液。取出25.00mL该溶液,加入0.050mol·L-1Ba(OH)2溶液至22.00mL时沉淀量达到最大。请计算:
(1)25℃时,0.050mol·L-1Ba(OH)2溶液中的氢氧根离子浓度是_______ mol/L
(2)样品中n(NaHCO3)∶n(Na2CO3)=_______ 。
(1)25℃时,0.050mol·L-1Ba(OH)2溶液中的氢氧根离子浓度是
(2)样品中n(NaHCO3)∶n(Na2CO3)=
您最近一年使用:0次
名校
2 . 下列实验的现象与对应结论均正确的是( )
| 操作 | 现象 | 结论 | |
| A | 向苏打和小苏打溶液中分别加入BaCl2溶液 | 前者出现沉淀,后者无现象 | 前者能与BaCl2反应, 后者不能 |
| B | 用酒精灯加热铝箔 | 铝熔化并滴落 | Al熔点较低 |
| C | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 溶液显红色 | Fe(NO3)2晶体已氧化变质 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-10-07更新
|
453次组卷
|
2卷引用:山东省淄博市淄川中学2018届高三上学期第一次月考化学试题
名校
3 . NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的一定质量的NaHCO3样品溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)

试求:
(1)该盐酸溶液的物质的量浓度为_______ mol·L-1。
(2)未变质前NaHCO3的物质的量为________ mol。

试求:
(1)该盐酸溶液的物质的量浓度为
(2)未变质前NaHCO3的物质的量为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.汉弗里·戴维是英国著名化学家,他提出:“电流与化合物的相互作用,是最有可能将所有物质分解为元素的方法”。通过这种方法,他制备得到了金属钾和钠。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:___________ 。
(2)关于金属钠,下列叙述正确的是___________
(3)钠在空气中燃烧产物的颜色是___________ , 电子式为___________ 。
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是___________ 。
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):
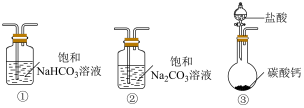
选取必要的实验装置,正确的连接顺序为___________ (填序号)。
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
此实验说明甲方案___________ (填“可行”或“不可行”)。
(7)产生浑浊(伴有气体产生)的离子方程式:___________ 。
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是___________ (填化学式)。
(1)戴维在1807年用电解熔融烧碱的方法制得金属钠,电极之间设置镍网做隔膜以分离电解产物,电解的总反应方程式为:
(2)关于金属钠,下列叙述正确的是___________
| A.钠可保存在煤油或CCl4等液态有机物中 |
| B.氯化钠在电流作用下电离出的钠离子和氯离子 |
| C.钠与硫在常温下化合就能剧烈反应,甚至发生爆炸 |
| D.若金属钠着火,可采用干粉灭火器灭火 |
(3)钠在空气中燃烧产物的颜色是
(4)ag钠完全燃烧后,将固体充分溶解在bg水中,所得溶液溶质的质量分数是
(5)某实验小组把 CO2通入饱和Na2CO3溶液制取NaHCO3,装置如下图所示(气密性已检验,部分夹持装置略):

选取必要的实验装置,正确的连接顺序为
Ⅱ.为确定制得的固体样品是纯净的 NaHCO3小组同学提出下列实验方案:
甲方案:将样品溶液与BaCl2溶液反应,观察现象
乙方案:测定 pH法
(6)为判定甲方案的可行性, 某同学用NaHCO3分析纯配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2溶液 | 0.2mol/L | 0.1mol/L | 0.02mol/L |
| 0.2mol/L | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol/L | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol/L | 少许浑浊 | 无现象 | 无现象 |
(7)产生浑浊(伴有气体产生)的离子方程式:
(8)乙方案是:取等质量的固体样品和分析纯 Na2CO3加等质量的水配制的溶液,分别与 pH 计测定 pH,pH更大的是
您最近一年使用:0次
名校
5 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
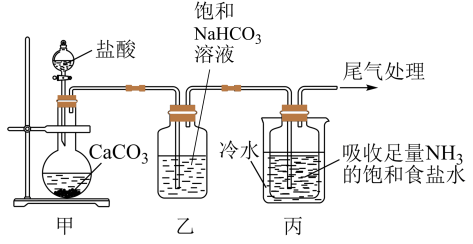
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
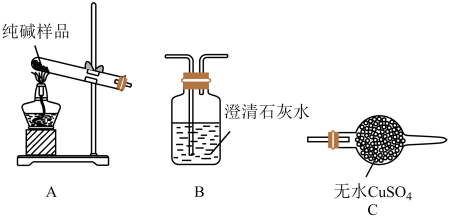
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:陕西省西安市长安区第一中学2021-2022学年高一上学期期末考试化学试题
解题方法
6 . 碳酸钠是一种重要化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,其步骤如下:①将氯化钠固体溶于水,并加入NH4HCO3粉末;②在30 ~ 50 °C条件下加热;③过滤,得到晶体A;④将晶体A在300°C加热,最后得到碳酸钠。已知:在铵盐的浓溶液中碳酸氢钠的溶解度较小。回答下列问题:
(1)步骤②中的加热方式是_______ 。
(2)写出生成晶体A的化学方程式_______ 。
(3)步骤④中“300° C加热”所选用的仪器是_______ (填标号)。
(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
(5)世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法,其流程为:流程I是向NaCl(s)中加浓H2SO4并加热到600 -700℃,获得Na2SO4(s) ;流程II是Na2SO4(s)中加木炭、石灰石并加热到1000℃,获得Na2CO3(s)。其中流程II的反应分步进行:①Na2SO4+4C Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为_______ ;Na2S在流程II中所起的作用有_______ (填编号)。
a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1_______ w2(选填“>”、“<”或“=”)。
(1)步骤②中的加热方式是
(2)写出生成晶体A的化学方程式
(3)步骤④中“300° C加热”所选用的仪器是

(4)下列有关碳酸钠和碳酸氢钠的叙述正确的是_______。
| A.常温下,向相同浓度的碳酸钠和碳酸氢钠溶液中各滴入2滴酚酞试液,前者红色更深 |
| B.碳酸钠的热稳定性弱于碳酸氢钠 |
| C.常温下,相同浓度的碳酸钠和碳酸氢钠分别与足量的等浓度盐酸反应,前者反应更剧烈 |
| D.在两支试管里分别加入碳酸钠固体和碳酸氢钠固体各1g,再各滴入几滴水,前者试管底部变热,后者变冷 |
 Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为
Na2S+4CO↑;②Na2S与石灰石发生复分解反应。流程II的总反应方程式为a.催化剂 b.中间产物 c.氧化产物 d.还原产物
(6)检验产品中是否有杂质碳酸氢钠:称取w1g样品于坩埚中,充分加热后,得到w2g残留固体。若含碳酸氢钠杂质,则w1
您最近一年使用:0次
解题方法
7 . I.由三种元素组成的化合物A,相对分子质量为62,常温下为无色晶体,易分解、易爆炸,水溶液中相对稳定,是一种二元弱酸,一定条件下还可用作还原剂。A的制备可以由工业盐经过如下步骤实现:

已知:钠汞齐是一种强还原剂,由钠溶于汞形成;C是氯碱工业产物之一。请回答:
(1)A的结构式:__________ (A中所有原子都满足稀有气体的最外层电子结构)。
(2)工业盐生成B和C的化学方程式:__________ 。
(3)请设计实验证明A是一种二元弱酸:__________ 。
II.为检验某纯碱样品中是否含有碳酸氢钠,可采用不同的方法。
实验室提供下列仪器与药品:酒精灯、铁架台及固定装置、带玻璃导管的单孔橡胶塞、试管、胶头滴管、蒸馏水、CaCl2溶液、澄清石灰水、酚酞试液、盐酸、NaOH溶液。
请根据所提供的仪器与药品设计两个可行的实验方案:__________ 。

已知:钠汞齐是一种强还原剂,由钠溶于汞形成;C是氯碱工业产物之一。请回答:
(1)A的结构式:
(2)工业盐生成B和C的化学方程式:
(3)请设计实验证明A是一种二元弱酸:
II.为检验某纯碱样品中是否含有碳酸氢钠,可采用不同的方法。
实验室提供下列仪器与药品:酒精灯、铁架台及固定装置、带玻璃导管的单孔橡胶塞、试管、胶头滴管、蒸馏水、CaCl2溶液、澄清石灰水、酚酞试液、盐酸、NaOH溶液。
请根据所提供的仪器与药品设计两个可行的实验方案:
您最近一年使用:0次
8 . Ⅰ.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是____________________ 。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________ 。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00 g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是_______________________________________ 。
②原样品中高铁酸钾的质量分数为______________ 。
Ⅲ.A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):A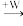 B
B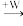 C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
(1)若将标准状况下2.24 L的W通入150 mL 1 mol·L-1的A溶液中,充分反应。总反应的离子方程式为______________________________________________ 。
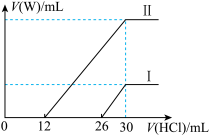
(2)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为__________ 。
Ⅳ.简述检验某液态卤代烃中是否含有氯元素的方法:_______________________ 。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
Ⅱ.工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解3.00 g K2FeO4样品,调节pH值使高铁酸根全部被还原成铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,滴定终点时,消耗Na2S2O3标准溶液18.00mL。
①滴定终点的现象是
②原样品中高铁酸钾的质量分数为
Ⅲ.A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):A
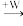 B
B C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
C。A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。(1)若将标准状况下2.24 L的W通入150 mL 1 mol·L-1的A溶液中,充分反应。总反应的离子方程式为
(2)向两份30 mL同浓度的A溶液中通入不同体积的W气体,得到溶液M、N。向M、N溶液中逐滴加入浓度为0.2 mol·L-1盐酸,如图所示,Ⅰ和Ⅱ分别为向M、N溶液中加入盐酸的体积V(HCl)与产生W气体的体积V(W)的关系。则M、N两溶液中相同溶质的物质的量之比为

Ⅳ.简述检验某液态卤代烃中是否含有氯元素的方法:
您最近一年使用:0次
2011·上海青浦·一模
解题方法
9 . 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水

四种盐在不同温度下的溶解度(g/100g水)表

(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是_______________ (填字母);
(2)A装置中盛放的试剂是_______________ ,其作用是_____________________ ;
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是____________________________ 为了便于控制此温度范围,采取的加热方法为___________ ;
(4)将锥形瓶中的产物过滤后,所得的母液中含有_____________________ (以化学式表示),可加入氯化钠,并进行_______ 操作,使NaCl溶液循环使用,同时可回收NH4Cl。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+→HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_____________________ 。

四种盐在不同温度下的溶解度(g/100g水)表

(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
(1)装置的连接顺序应是
(2)A装置中盛放的试剂是
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是
(4)将锥形瓶中的产物过滤后,所得的母液中含有
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+→HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
您最近一年使用:0次



