解题方法
1 . I.通过海水晾晒可得粗盐,粗盐中除NaCl外,还含有 、
、 、
、 以及泥沙等杂质,为了将粗盐有效提纯,实验的各步操作流程如下:
以及泥沙等杂质,为了将粗盐有效提纯,实验的各步操作流程如下:______ (填名称)。
(2)操作溶解、过滤、蒸发都用到一种玻璃仪器是______ (填仪器名称),
(3)试剂a由三种试剂构成,除杂步骤中试剂可行的添加顺序有______(填标号)。
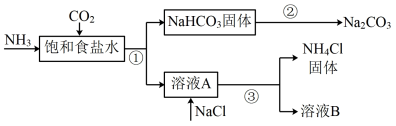
Ⅱ.某研究小组利用提纯后精盐配制饱和NaCl溶液,模拟侯德榜制碱法制取碱,流程如图:
(4)装置Ⅰ中,往饱和食盐水中优先通入的气体为______ (填化学式),装置Ⅰ中反应的化学方程式为____________ ;
(5)该流程中可循环利用的物质是______ (填化学式)
 、
、 、
、 以及泥沙等杂质,为了将粗盐有效提纯,实验的各步操作流程如下:
以及泥沙等杂质,为了将粗盐有效提纯,实验的各步操作流程如下:
(2)操作溶解、过滤、蒸发都用到一种玻璃仪器是
(3)试剂a由三种试剂构成,除杂步骤中试剂可行的添加顺序有______(填标号)。
A.① ② ② ③NaOH ③NaOH | B.① ②NaOH③ ②NaOH③ |
C.①NaOH② ③ ③ | D.① ② ② ③NaOH ③NaOH |
Ⅱ.某研究小组利用提纯后精盐配制饱和NaCl溶液,模拟侯德榜制碱法制取碱,流程如图:

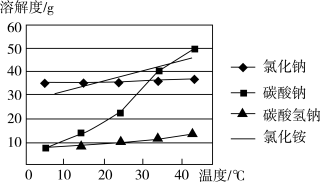
| 物质 | NaCl |  |  |  |
| 溶解度 | 36.0 | 21.7 | 9.6 | 37.2 |
(4)装置Ⅰ中,往饱和食盐水中优先通入的气体为
(5)该流程中可循环利用的物质是
您最近一年使用:0次
解题方法
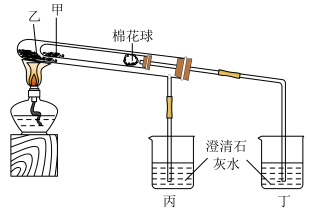
2 . 高氯酸铜晶体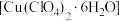 易溶于水,120℃开始分解,常用于生产电极和燃烧的催化剂等.实验室以硫酸铜为原料制备少量高氯酸铜晶体的步骤如下:
易溶于水,120℃开始分解,常用于生产电极和燃烧的催化剂等.实验室以硫酸铜为原料制备少量高氯酸铜晶体的步骤如下:
Ⅰ.称取12.5g 和9.6g
和9.6g ,混合研细后,投入100mL70~80℃热水,快速搅拌,静置得绿色沉淀
,混合研细后,投入100mL70~80℃热水,快速搅拌,静置得绿色沉淀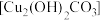 ;
;
Ⅱ.冷却,过滤,用少量蒸馏水洗涤沉淀2~3次;
Ⅲ.在沉淀中慢慢滴加70% 溶液,适度加热搅拌至不再产生气体;
溶液,适度加热搅拌至不再产生气体;
Ⅳ.过滤,得蓝色高氯酸铜溶液;
Ⅴ.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,冷却、结晶、过滤、洗涤,得蓝色晶体;
Ⅵ.60℃下,在烘箱中干燥2h,得16.695g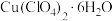 晶体。
晶体。
回答下列问题:
(1)“步骤Ⅰ”中研磨用到的仪器名称是________ ,“步骤Ⅴ”中蒸发需要用到下列仪器中的________ (填字母序号). 和
和 研细的目的是
研细的目的是________________ ,写出它们在溶液中反应生成 的离子方程式:
的离子方程式:________________ ,实际操作中 与
与 的物质的量之比大于
的物质的量之比大于 ,原因是
,原因是________________ 。
(3)“步骤Ⅱ”中检验沉淀是否洗净所需试剂为________ 。
(4)“步骤Ⅴ”在通风橱中进行的原因是________________ 。
(5)某温度下,高氯酸铜同时按以下两种方式分解:(A)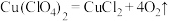 ;(B)
;(B)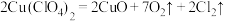 ,若测得
,若测得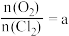 ,则按(A)式分解的高氯酸铜的质量分数为
,则按(A)式分解的高氯酸铜的质量分数为________ (用含a的代数式表示)。
(6)上述过程中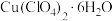 的产率为
的产率为________ 。
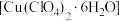 易溶于水,120℃开始分解,常用于生产电极和燃烧的催化剂等.实验室以硫酸铜为原料制备少量高氯酸铜晶体的步骤如下:
易溶于水,120℃开始分解,常用于生产电极和燃烧的催化剂等.实验室以硫酸铜为原料制备少量高氯酸铜晶体的步骤如下:Ⅰ.称取12.5g
 和9.6g
和9.6g ,混合研细后,投入100mL70~80℃热水,快速搅拌,静置得绿色沉淀
,混合研细后,投入100mL70~80℃热水,快速搅拌,静置得绿色沉淀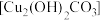 ;
;Ⅱ.冷却,过滤,用少量蒸馏水洗涤沉淀2~3次;
Ⅲ.在沉淀中慢慢滴加70%
 溶液,适度加热搅拌至不再产生气体;
溶液,适度加热搅拌至不再产生气体;Ⅳ.过滤,得蓝色高氯酸铜溶液;
Ⅴ.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,冷却、结晶、过滤、洗涤,得蓝色晶体;
Ⅵ.60℃下,在烘箱中干燥2h,得16.695g
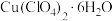 晶体。
晶体。回答下列问题:
(1)“步骤Ⅰ”中研磨用到的仪器名称是
 和
和 研细的目的是
研细的目的是 的离子方程式:
的离子方程式: 与
与 的物质的量之比大于
的物质的量之比大于 ,原因是
,原因是(3)“步骤Ⅱ”中检验沉淀是否洗净所需试剂为
(4)“步骤Ⅴ”在通风橱中进行的原因是
(5)某温度下,高氯酸铜同时按以下两种方式分解:(A)
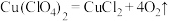 ;(B)
;(B)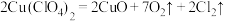 ,若测得
,若测得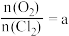 ,则按(A)式分解的高氯酸铜的质量分数为
,则按(A)式分解的高氯酸铜的质量分数为(6)上述过程中
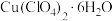 的产率为
的产率为
您最近一年使用:0次
2024-05-20更新
|
82次组卷
|
2卷引用:河南省九师联盟2023-2024学年高三下学期5月月考理综试题-高中化学
名校
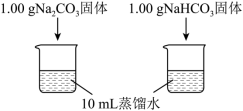
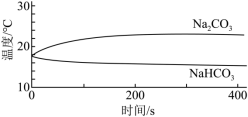
3 . Ⅰ.实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】
溶液pH越小,OH- 的浓度越小,溶液碱性越弱。
【实验过程】
【分析与解释】
(1)实验Ⅰ中,溶解时吸收热量的物质是___________ (填化学式)。
(2)实验Ⅱ中,Na2CO3溶液和澄清石灰水反应的离子方程式为___________ ,OH- 未参与该反应的实验证据是___________ 。
(3)实验Ⅱ中,滴加NaHCO3溶液的烧杯中溶液pH的变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,___________ (填离子符号)参与了反应。
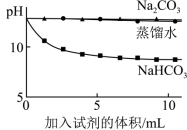
Ⅱ.向Na2CO3和NaHCO3的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示:___________ 、___________ 。
(5)B点时,反应所得溶液中溶质是___________ 。
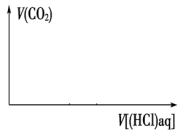
(6)将题中的NaHCO3改为NaOH时,请在下图中画出V(CO2)-V(HCl)的大致图像___________ 。
【查阅资料】
溶液pH越小,OH- 的浓度越小,溶液碱性越弱。
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验Ⅰ | 测量下面实验过程中温度的变化
|
|
| 实验Ⅱ | 测量下面实验过程中溶液pH的变化
|
|
(1)实验Ⅰ中,溶解时吸收热量的物质是
(2)实验Ⅱ中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验Ⅱ中,滴加NaHCO3溶液的烧杯中溶液pH的变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,
Ⅱ.向Na2CO3和NaHCO3的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
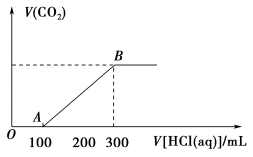
(5)B点时,反应所得溶液中溶质是
(6)将题中的NaHCO3改为NaOH时,请在下图中画出V(CO2)-V(HCl)的大致图像
您最近一年使用:0次
名校
解题方法
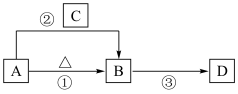
4 . 我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。___________ (填化学式),俗称___________
(2)①~③所涉及的操作方法中,包含过滤的是___________ (填序号)。
(3)该生产过程中,可循环使用的物质是下列说法中,正确的是___________ (填字母)。
A. 可循环使用
可循环使用
B. 副产物可用作肥料
副产物可用作肥料
C.溶液B中一定不含 、
、
(4)已知 极易溶于水,
极易溶于水, 微溶于水,在饱和食盐水中,建议先通入气体
微溶于水,在饱和食盐水中,建议先通入气体___________ (填名称)。
(5)①利用下图比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为___________ 。
②若要除去碳酸钠溶液中的碳酸氢钠,发生反应的离子方程式为___________ 。
(2)①~③所涉及的操作方法中,包含过滤的是
(3)该生产过程中,可循环使用的物质是下列说法中,正确的是
A.
 可循环使用
可循环使用 B.
 副产物可用作肥料
副产物可用作肥料C.溶液B中一定不含
 、
、
(4)已知
 极易溶于水,
极易溶于水, 微溶于水,在饱和食盐水中,建议先通入气体
微溶于水,在饱和食盐水中,建议先通入气体(5)①利用下图比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为
②若要除去碳酸钠溶液中的碳酸氢钠,发生反应的离子方程式为
A. | B. | C. | D.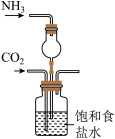 |
您最近一年使用:0次
解题方法
5 . A、B、C、D四种化合物均由前三周期元素组成,其中A含有四种元素,A、B、C的焰色反应均为黄色,C为强碱,D为产生温室气体效应的气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
(1)反应①的化学方程式为___________ 。
(2)反应②的离子方程式为___________ 。
(3)向B溶液中加入熟石灰可制烧碱,该反应的化学方程式为___________ 。
(1)反应①的化学方程式为
(2)反应②的离子方程式为
(3)向B溶液中加入熟石灰可制烧碱,该反应的化学方程式为
您最近一年使用:0次
6 . 在化学课上老师向NaOH溶液通入 后无明显现象。
后无明显现象。
(提出问题)如何通过实验证明 与NaOH发生了反应?
与NaOH发生了反应?
[查阅资料]①碳酸钠溶液中滴加少量的稀盐酸,会先反应生成碳酸氢钠(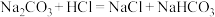 )
)
②碳酸钠在二氧化碳过量的条件继续与水和二氧化碳反应生成碱性较弱的碳酸氢钠。
(设计实验)
(1)反应物之-- 消失的角度,某同学设计了如下图所示的实验,打开活塞,向充满
消失的角度,某同学设计了如下图所示的实验,打开活塞,向充满 的瓶中滴入NaOH溶液,一会儿后观察到的现象是
的瓶中滴入NaOH溶液,一会儿后观察到的现象是________ 。据此现象判断NaOH与 发生了化学反应。
发生了化学反应。________ 。
(2)假设生成物为 ,分别设计了以下两个实验方案:
,分别设计了以下两个实验方案:
(实验拓展)该小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化技术测定溶液pH变化,如图所示。请用化学方程式回答下列问题:________ ;
(4)CD段pH低于7的原因可能是________ 。
 后无明显现象。
后无明显现象。(提出问题)如何通过实验证明
 与NaOH发生了反应?
与NaOH发生了反应?[查阅资料]①碳酸钠溶液中滴加少量的稀盐酸,会先反应生成碳酸氢钠(
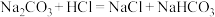 )
)②碳酸钠在二氧化碳过量的条件继续与水和二氧化碳反应生成碱性较弱的碳酸氢钠。
(设计实验)
(1)反应物之--
 消失的角度,某同学设计了如下图所示的实验,打开活塞,向充满
消失的角度,某同学设计了如下图所示的实验,打开活塞,向充满 的瓶中滴入NaOH溶液,一会儿后观察到的现象是
的瓶中滴入NaOH溶液,一会儿后观察到的现象是 发生了化学反应。
发生了化学反应。
(2)假设生成物为
 ,分别设计了以下两个实验方案:
,分别设计了以下两个实验方案:实验操作 | 实验现象 | 结论 |
| 方案一:向实验(1)所得的溶液中加入 | 有白色沉淀产生 | 有新物质 生成,发生反应。 生成,发生反应。 |
| 方案二:向实验(1)所得溶液中滴加过量稀盐酸 |
(实验拓展)该小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化技术测定溶液pH变化,如图所示。请用化学方程式回答下列问题:
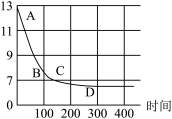
(4)CD段pH低于7的原因可能是
您最近一年使用:0次
名校
7 . 已知X、Y和Z为中学化学中的常见元素﹐根据如图所示转化关系(反应条件及部分产物已略去)。回答下列问题:

(1)若A、B、C、D均为含X的化合物。A常用作制冷剂,D是一种强酸,则
①反应I的化学方程式为___________ 。
②常温下,C的颜色为___________ 色。
③足量的铜与一定量的D的浓溶液充分反应,向所得溶液中加入100mL 4 NaOH溶液,
NaOH溶液, 恰好沉淀完全。则消耗铜的质量为
恰好沉淀完全。则消耗铜的质量为___________ g。
(2)若A、B、C、D均为含Y的化合物。A是一元强碱且焰色为黄色,E是“碳中和”的主角,则B的化学式为___________ ;C的用途有___________ (任写一种);E的空间结构为___________ 。
(3)若A、B、C、D均为含Z的化合物。A为黄铁矿的主要成分,D为强酸,则
①A在空气中煅烧生成氧化铁的化学方程式为___________ 。
②C→D的过程中选择用98.3%的浓硫酸吸收而不用 吸收的原因是
吸收的原因是___________ 。

(1)若A、B、C、D均为含X的化合物。A常用作制冷剂,D是一种强酸,则
①反应I的化学方程式为
②常温下,C的颜色为
③足量的铜与一定量的D的浓溶液充分反应,向所得溶液中加入100mL 4
 NaOH溶液,
NaOH溶液, 恰好沉淀完全。则消耗铜的质量为
恰好沉淀完全。则消耗铜的质量为(2)若A、B、C、D均为含Y的化合物。A是一元强碱且焰色为黄色,E是“碳中和”的主角,则B的化学式为
(3)若A、B、C、D均为含Z的化合物。A为黄铁矿的主要成分,D为强酸,则
①A在空气中煅烧生成氧化铁的化学方程式为
②C→D的过程中选择用98.3%的浓硫酸吸收而不用
 吸收的原因是
吸收的原因是
您最近一年使用:0次
名校
解题方法
8 . 我国化工专家侯德榜提出将氨碱法与合成氨联合生产的改进工艺,这就是联合制碱法,也称侯氏制碱法。侯氏制碱法的工业生产分为两个过程,分别为生产纯碱的制碱过程和生产氯化铵的制氨过程。工艺流程如下:
(1)“产品1”的化学式为___________ ,“过滤”后得到“产品1”的方法为___________ ,写出“产品2”的一种常见用途___________ 。
(2)写出“碳化”时发生反应的化学方程式___________
(3)采用“冷析”分离出产品2的原因是___________
(4)关于“母液1”的说法正确的是___________ (填序号)。
A.“母液1”中主要含有 、
、 、
、 、
、
B.“母液1”与“母液2”成分相同
C.“母液1”中溶质只有氯化铵
(5)研究表明,“吸氨2”不仅可以促进“产品2”的分离还可以减少某种杂质的析出,写出“吸氨2”中反应的离子方程式___________ 。

(1)“产品1”的化学式为
(2)写出“碳化”时发生反应的化学方程式
(3)采用“冷析”分离出产品2的原因是
(4)关于“母液1”的说法正确的是
A.“母液1”中主要含有
 、
、 、
、 、
、
B.“母液1”与“母液2”成分相同
C.“母液1”中溶质只有氯化铵
(5)研究表明,“吸氨2”不仅可以促进“产品2”的分离还可以减少某种杂质的析出,写出“吸氨2”中反应的离子方程式
您最近一年使用:0次
解题方法
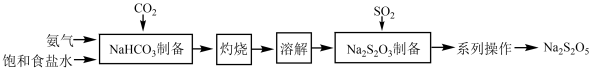
9 . 焦亚硫酸钠(Na2S2O5)在化学工业中用途广泛。其一种制备流程如下:
(1)SO2分子的VSEPR模型为___________ 。
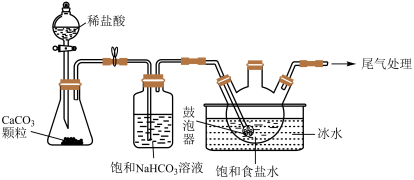
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:___________ 。
②饱和碳酸氢钠溶液的作用是___________ 。
③三颈烧瓶中生成NaHCO3反应的化学方程式为___________ (NaHCO3为沉淀物)。
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是___________ 。
②写出步骤Ⅱ中反应的离子方程式:___________ 。
③写出I~Ⅳ步骤中总反应的化学方程式:___________ 。
(1)SO2分子的VSEPR模型为
(2)“NaHCO3制备”所用实验装置(夹持仪器已省略)如下图:
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成NaHCO3反应的化学方程式为
(3)“Na2S2O5制备”反应过程分四步:
步骤I.在碳酸钠溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
步骤Ⅱ.停止通SO2,向NaHSO3溶液中再加入Na2CO3溶液调至pH为7~8,转化为Na2SO3;
步骤Ⅲ.继续通入SO2至pH达4.1,又生成NaHSO3溶液;
步骤Ⅳ.当溶液中NaHSO3含量达到过饱和浓度时析出Na2S2O5。
①步骤I测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出I~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
名校
解题方法
10 . 以食盐为钠源制备纯碱的一种工艺流程如图。 碳酸化,过滤。
碳酸化,过滤。
①煅烧滤渣制取纯碱的化学方程式为_____ 。
②滤渣成分可作膨松剂,制馒头时与食醋( )共用效果更佳,相关的离子方程式为
)共用效果更佳,相关的离子方程式为_____ 。
(2)该流程中,可以循环利用的物质有 和
和_____ 。

 碳酸化,过滤。
碳酸化,过滤。①煅烧滤渣制取纯碱的化学方程式为
②滤渣成分可作膨松剂,制馒头时与食醋(
 )共用效果更佳,相关的离子方程式为
)共用效果更佳,相关的离子方程式为(2)该流程中,可以循环利用的物质有
 和
和
您最近一年使用:0次