解题方法
1 . 加热10.0g碳酸钠和碳酸氢钠的混合物至质量不再变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数
| A.42% | B.58% | C.29% | D.50% |
您最近一年使用:0次
2022-09-19更新
|
288次组卷
|
3卷引用:黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题
黑龙江省齐齐市拜泉县第一中学2021-2022学年高一上学期期中考试化学试题广东省惠州市博罗县2022-2023学年高一上学期期中考试化学试题(已下线)【2022】【高一上】【期中考】【杭九】【高中化学】【赵优萍收集】
名校
2 . 侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
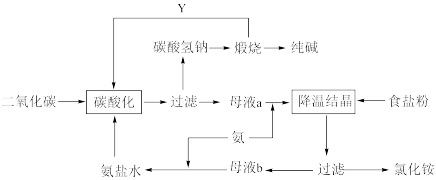
Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是___________
A.原料利用率高 B.设备少 C.生产方便
(2)碳酸化这一步的原理是(用化学方程式表示)___________
(3)侯氏制碱法副产品的一种用途为___________ 。
(4)Y物质是___________ 。
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少的NaCl,现欲测定某碳酸钠样品中 的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
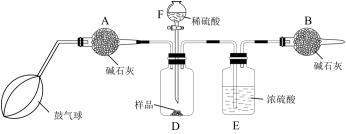
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量( )。
)。
③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质( )。
)。
⑧计算
(5)操作⑥中,鼓入空气的作用是___________ ;
(6)根据题干所给的数据列出样品中 的质量分数表达式
的质量分数表达式___________ 。
(7)经实验发现最终所得的 的质量分数超过100%,其可能的原因是
的质量分数超过100%,其可能的原因是___________ 。

Ⅰ.根据以上流程回答下列问题:
(1)与索尔维制碱法相比,侯氏制碱法最突出的优点是
A.原料利用率高 B.设备少 C.生产方便
(2)碳酸化这一步的原理是(用化学方程式表示)
(3)侯氏制碱法副产品的一种用途为
(4)Y物质是
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少的NaCl,现欲测定某碳酸钠样品中
 的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
的质量分数,某探究性学习小组取样品b g设计了如下实验方案。
该实验的操作步骤如下:
①如图连接装置(除B外)并加入所需药品。
②称量并记录B的质量(
 )。
)。③按动鼓气球,持续约1分钟。
④连接上B。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质(
 )。
)。⑧计算
(5)操作⑥中,鼓入空气的作用是
(6)根据题干所给的数据列出样品中
 的质量分数表达式
的质量分数表达式(7)经实验发现最终所得的
 的质量分数超过100%,其可能的原因是
的质量分数超过100%,其可能的原因是
您最近一年使用:0次
名校
3 . 物质的量是联系宏观和微观的桥梁,请回答下列问题:
(1)将NaOH、 的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示,回答下列问题:
的体积(标准状况)关系如图所示,回答下列问题:
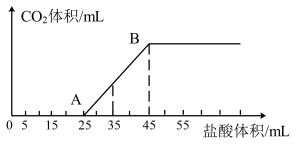
①AB段发生反应的离子方程式为_______ 。
②当加入35mL盐酸时,产生 的体积(标准状况)为
的体积(标准状况)为_______ mL。
③原混合溶液中NaOH与 的物质的量之比为
的物质的量之比为_______ 。
(2)用质量分数为98%的浓硫酸(密度为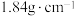 )配制成
)配制成 的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:
的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:
①经计算,浓硫酸的浓度为_______  。
。
②本实验必须用到的仪器有量筒、烧杯、玻璃棒、_______ 、_______ 。
③若出现以下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
Ⅰ.没有用蒸馏水洗涤烧杯和玻璃棒_______ 。
Ⅱ.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线_______ 。
(1)将NaOH、
 的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示,回答下列问题:
的体积(标准状况)关系如图所示,回答下列问题:
①AB段发生反应的离子方程式为
②当加入35mL盐酸时,产生
 的体积(标准状况)为
的体积(标准状况)为③原混合溶液中NaOH与
 的物质的量之比为
的物质的量之比为(2)用质量分数为98%的浓硫酸(密度为
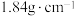 )配制成
)配制成 的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:
的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:①经计算,浓硫酸的浓度为
 。
。②本实验必须用到的仪器有量筒、烧杯、玻璃棒、
③若出现以下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
Ⅰ.没有用蒸馏水洗涤烧杯和玻璃棒
Ⅱ.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
您最近一年使用:0次
名校
解题方法
4 . 实验室有一包白色固体,可能含有Na2CO3、NaHCO3中的一种或两种,下列说法正确的是
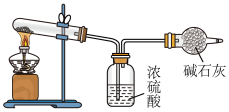

| A.取一定量固体,溶解配成饱和溶液,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 |
| B.取样在试管中加热,将可能产生的气体全部通入澄清石灰水,若最终仍为澄清溶液,则样品中一定不含NaHCO3 |
| C.取一定量的样品,利用如图所示装置测定样品中NaHCO3的含量,若球形干燥管增重4.4g,则所取样品中含有8.4gNaHCO3 |
| D.已知固体样品同时含有NaHCO3和Na2CO3。现取一定质量的样品配成溶液,滴加Ba(OH)2溶液至沉淀完全,根据白色沉淀的质量不能求出Na2CO3的含量 |
您最近一年使用:0次
2023-10-24更新
|
275次组卷
|
2卷引用:黑龙江省大庆市东风中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
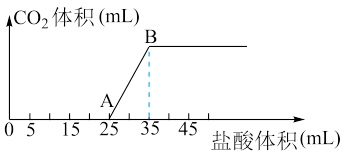
5 . 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水配成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积 标准状况
标准状况 关系如图所示。
关系如图所示。
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有____ (填化学式)。
(2)AB段发生的离子反应方程式____ 。
(3)当到达B点时,产生CO2的体积为____ mL(标准状况)。
(4)计算原混合物中Na2CO3的质量分数____ (结果保留3位有效数字)
 标准状况
标准状况 关系如图所示。
关系如图所示。
请回答下列问题:
(1)OA段是盐酸与Na2CO3和NaOH发生的反应,反应后溶液中的溶质有
(2)AB段发生的离子反应方程式
(3)当到达B点时,产生CO2的体积为
(4)计算原混合物中Na2CO3的质量分数
您最近一年使用:0次
名校
解题方法
6 . 纯碱是重要的生活用碱和化工原料,用途广泛。请同学们按要求回答问题。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。
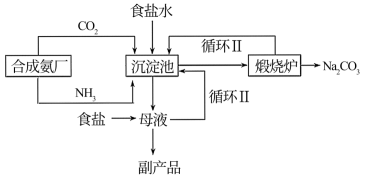
(1)请写出煅烧炉中发生反应的化学方程式:___________ 。
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为___________ ,循环Ⅰ中物质的主要成分是___________ 。(本小题涉及到的物质均写化学式)
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。
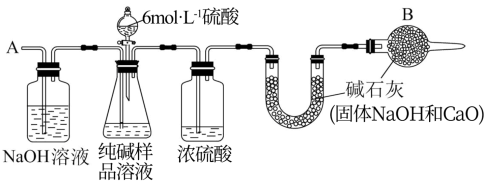
主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是___________ 。
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将___________ (填“偏高”、“偏低”或“不变”)。
(5)步骤⑤的目的是___________ 。
(6)步骤⑦的目的是___________ 。
(7)该样品中纯碱的质量分数的计算式为___________ 。
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是___________ 。
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
Ⅰ.纯碱生产:我国化学家侯德榜改革国外的纯碱生产工艺,其生产流程可简要表示如下。

(1)请写出煅烧炉中发生反应的化学方程式:
(2)侯氏制碱的创新之处:根据NH4Cl在常温时的溶解度比NaCl大,而在低温下却比NaCl溶解度小的原理,在5℃~10℃时,向母液中加入食盐细粉,而使NH4Cl单独结晶析出供做氮肥,大大提高了原料利用率、降低了生产成本,为世界制碱业做出了巨大贡献。依据上述信息可知,副产品的成分为
Ⅱ.产品纯度的测定:上述生产中获得的纯碱产品中含有少量NaCl杂质,为测定该样品中纯碱的质量分数,可用如图所示的装置进行实验。

主要实验步骤如下:
①按如图所示装置来组装仪器,并检查装置的气密性;
②将a g纯碱样品放入锥形瓶中,加入适量蒸馏水溶解,得到纯碱样品溶液;
③称量盛有碱石灰的U形管的质量为b g;
④通过分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U形管的质量为c g;
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g.
请回答下列问题:
(3)装置中干燥管B的作用是
(4)从A处通入的空气如果不经过NaOH溶液,测量结果将
(5)步骤⑤的目的是
(6)步骤⑦的目的是
(7)该样品中纯碱的质量分数的计算式为
(8)如果所得产品中除含有少量NaCl杂质外还含有少量NaHCO3杂质,下列实验方案中能测定出产品中纯碱的质量分数的是
A.取a g产品充分加热,质量减少b g。
B.取a g产品与足量Ba(OH)2溶液反应,过滤、洗涤、干燥,得到b g固体。
C.取a g产品与足量BaCl2溶液反应,过滤、洗涤、干燥,得到b g固体。
您最近一年使用:0次
名校
7 . 下列试验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是
| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量CaCl2溶液反应,过滤、洗涤、烘干得到bg固体 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg |
您最近一年使用:0次
2021-12-04更新
|
1011次组卷
|
7卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题
黑龙江省鹤岗市第一中学2022-2023学年高一上学期11月期中化学试题湖南省石门县第一中学2021-2022学年高一上学期期中段考化学试题(已下线)专题36 碳酸钠质量分数测定的实验探究-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)江西省宜春市铜鼓中学2021-2022学年高一下学期开学考化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题河南省顶级名校2023届高三上学期10月月考化学试题宁夏回族自治区银川一中2023-2024学年高一上学期期中考试化学试题
名校
8 . 下列关于Na2CO3、NaHCO3的叙述正确的是
| A.Na2CO3溶液、NaHCO3溶液可以用澄清石灰水鉴别 |
| B.分别向Na2CO3溶液和NaHCO3溶液中滴加少量盐酸,产生CO2气体较快的为Na2CO3溶液 |
| C.充分加热agNa2CO3和NaHCO3的混合固体,根据固体质量减重bg,可以计算出混合固体中Na2CO3的质量分数 |
| D.溶解度:Na2CO3<NaHCO3 |
您最近一年使用:0次
名校
9 . I、某化学课外活动小组欲制取纯Na2CO3溶液并讨论实验过程中的相关问题,可供选择的试剂有:A.大理石 B.盐酸 C.氢氧化钠溶液 D.澄清石灰水
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液 Na2CO3溶液
Na2CO3溶液
乙:NaOH溶液 NaHCO3溶液
NaHCO3溶液 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液
丙:NaOH溶液 NaHCO3溶液
NaHCO3溶液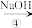 Na2CO3溶液
Na2CO3溶液
请回答下列问题:
(1)___________ 方案最优,其实验的关键是:_________ 。
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学___________ (填“能”或“不能”)达到实验目的;若能,请说明计算所需的数据;若不能,请简要说明理由:___________ 。
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需___________ g的NaOH固体;实验中用到的玻璃仪器除了烧杯、玻璃棒、胶头滴管、量筒、试剂瓶,还需要___________ 。
(4)下列实验步骤,正确的操作顺序是:___________ 。
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将___________ (填“偏高”、“偏低”或“无影响”,下同);如果上述D操作中用滤纸称量固体,所配溶液的浓度将___________ ;如果上述C操作中目光俯视,所配溶液的浓度将___________ 。
甲、乙、丙三位同学设计的制备实验方案的反应流程分别如下:
甲:NaOH溶液
 Na2CO3溶液
Na2CO3溶液乙:NaOH溶液
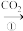 NaHCO3溶液
NaHCO3溶液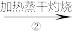 Na2CO3固体
Na2CO3固体 Na2CO3溶液
Na2CO3溶液丙:NaOH溶液
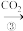 NaHCO3溶液
NaHCO3溶液 Na2CO3溶液
Na2CO3溶液请回答下列问题:
(1)
(2)假设反应②所得的Na2CO3固体中混有未分解的NaHCO3,乙同学选择澄清石灰水测定其中NaHCO3的质量分数,乙同学
II、若以上所需氢氧化钠溶液需要配制成98mL1.0mol/L的溶液,回答以下问题:
(3)计算:需
(4)下列实验步骤,正确的操作顺序是:
A.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
B.把已冷却的氢氧化钠溶液注入已查漏的容量瓶中
C.继续往容量瓶中加蒸馏水,使液面接近刻度线1-2cm处改用胶头滴管滴加蒸馏水,使液面达到刻度线
D.根据计算,用天平称取一定质量的氢氧化钠固体置于小烧杯中加入水溶解,并不断搅拌
E.盖上容量瓶的塞子,振荡,摇匀
(5)如果上述B操作中把未冷却的氢氧化钠溶液注入容量瓶中,所配溶液的浓度将
您最近一年使用:0次
名校
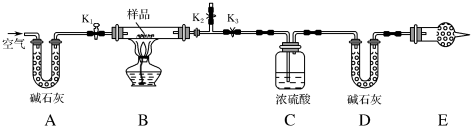
10 . 现有含 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是___________ 。
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是___________ 。
④关闭 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为___________ 、___________ 。
⑤打开 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是___________ 。
②E处干燥管中盛放的药品是___________ ,其作用是___________ ,如果实验中没有该装置,则会导致测量结果中 的质量分数
的质量分数___________ (填“偏大”“偏小”或“无影响”)。
 、
、 和
和 的混合物,某同学设计如图所示的实验装置,通过测量反应产生的
的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 和
和 的质量,来确定该混合物中各组分的质量分数。
的质量,来确定该混合物中各组分的质量分数。
(1)实验步骤:
①按图(夹持装置已省略)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中;称量盛装浓硫酸的洗气瓶C的质量和盛装碱石灰的U形管D的质量。
③打开
 、
、 ,关闭
,关闭 ,缓缓鼓入空气数分钟,其目的是
,缓缓鼓入空气数分钟,其目的是④关闭
 、
、 ,打开
,打开 ,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为⑤打开
 ,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对测定结果的影响是
②E处干燥管中盛放的药品是
 的质量分数
的质量分数
您最近一年使用:0次
2021-09-29更新
|
306次组卷
|
3卷引用:黑龙江省齐齐哈尔市齐齐哈尔中学2020-2021学年高一上学期期中考试化学试卷



