名校
1 . 随着能源技术的发展,科学家们将目光聚焦于锂的开发与研究。
(1)锂元素的性质与原子结构密切相关。锂的原子结构示意图是_______ 。
(2)已知: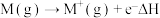 (
( 代表碱金属元素)
代表碱金属元素)
①根据以上数据,元素的金属性与△H的关系是_______ 。
②从原子结构的角度解释①中结论:_______ 。
③下列关于碱金属元素及其单质的叙述中,正确的是_______ (填字母)。
A.金属钠着火,要用泡沫灭火剂扑灭 B.阳离于氧化性:Li+>Na+>K+>Rb+
C.单质熔点:Li<Na<K<Rb D.与水反应的能力:Na<K
(3)锂-空气电池直接使用金属锂作电极,从空气中获得O2。如图是某种锂空气电池的示意图。

①金属锂是_______ 极(填“正”或“负”)。
②图中的有机电解质非水溶液不能替换成水溶液,用化学方程式表示其原因是_______ 。
③多孔碳电极上发生反应的电极反应式是_______ 。
(1)锂元素的性质与原子结构密切相关。锂的原子结构示意图是
(2)已知:
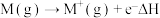 (
( 代表碱金属元素)
代表碱金属元素)| 元素 | Li | Na | K | Rb | Cs |
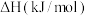 |  |  | 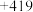 | 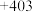 | 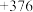 |
②从原子结构的角度解释①中结论:
③下列关于碱金属元素及其单质的叙述中,正确的是
A.金属钠着火,要用泡沫灭火剂扑灭 B.阳离于氧化性:Li+>Na+>K+>Rb+
C.单质熔点:Li<Na<K<Rb D.与水反应的能力:Na<K
(3)锂-空气电池直接使用金属锂作电极,从空气中获得O2。如图是某种锂空气电池的示意图。

①金属锂是
②图中的有机电解质非水溶液不能替换成水溶液,用化学方程式表示其原因是
③多孔碳电极上发生反应的电极反应式是
您最近一年使用:0次
2 . 电池级 广泛应用于高能锂电池制造领域。一种以铁锂云母(主要成分为
广泛应用于高能锂电池制造领域。一种以铁锂云母(主要成分为 、
、 、
、 、
、 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:

回答下列问题:
(1)已知36.5%盐酸的密度为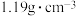 ,则该溶液中
,则该溶液中
__________ ;“溶解”时;为了提高溶解速率,可采取的措施为__________ (写两点)。
(2)从工业生产实际分析,氧化时加入物质A的最佳选择为______ (填选项字母),该步骤的离子方程式为__________ 。
a. b.
b. c.空气 d.
c.空气 d.
(3)“沉铁”时生成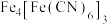 ,则“转化”时发生反应的离子方程式为
,则“转化”时发生反应的离子方程式为__________ 。
(4)“电渗析”的装置如下图所示,则M电极与外接电源的__________ 极相连;x、y为离子交换膜,则x为______ 离子交换膜(填“阴”或“阳”);结合流程分析电渗析的目的为__________ 。
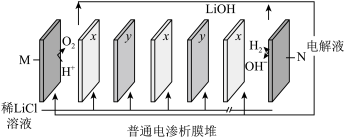
(5)实验室进行蒸发操作时,用到的主要仪器为__________ 、玻璃棒和酒精灯。
 广泛应用于高能锂电池制造领域。一种以铁锂云母(主要成分为
广泛应用于高能锂电池制造领域。一种以铁锂云母(主要成分为 、
、 、
、 、
、 、
、 等)为原料制备
等)为原料制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)已知36.5%盐酸的密度为
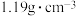 ,则该溶液中
,则该溶液中
(2)从工业生产实际分析,氧化时加入物质A的最佳选择为
a.
 b.
b. c.空气 d.
c.空气 d.
(3)“沉铁”时生成
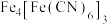 ,则“转化”时发生反应的离子方程式为
,则“转化”时发生反应的离子方程式为(4)“电渗析”的装置如下图所示,则M电极与外接电源的

(5)实验室进行蒸发操作时,用到的主要仪器为
您最近一年使用:0次
3 . 下表为元素周期表的短周期部分,①~⑦代表七种短周期元素。
已知:⑤的焰色试验火焰呈黄色。
请填写下列空白:
(1)②在元素周期表中的位置为___________ ;①的原子结构示意图为___________ 。
(2)③的一种核素的中子数为10,其原子符号为___________ (用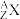 形式表示)。
形式表示)。
(3)④和⑦中非金属性较弱的是___________ (填元素符号)。
(4)①和⑤中原子半径较大的是___________ (填元素符号),与⑤同族的下一周期元素和③的最简单氢化物反应的离子方程式为___________ 。
(5)将⑥的氧化物加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为___________ 。
| ① | ② | ③ | ④ | |||
| ⑤ | ⑥ | ⑦ |
请填写下列空白:
(1)②在元素周期表中的位置为
(2)③的一种核素的中子数为10,其原子符号为
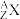 形式表示)。
形式表示)。(3)④和⑦中非金属性较弱的是
(4)①和⑤中原子半径较大的是
(5)将⑥的氧化物加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
4 . 联合国大会将2019年定为“化学元素周期表国际年”,表明了元素周期律的重要性。以下短周期主族元素中,含元素a的化合物被广泛用于制作手机电池,古迪纳夫因在该领域做出了杰出贡献荣获2019年诺贝尔化学奖。
(1)a原子结构示意图为___________ 。
(2)b、c、d三种元素的气态氢化物中,其中最稳定的是___________ (写化学式)。
(3)元素e与c能形成一种淡黄色物质,该物质与二氧化碳反应方程式为___________ 。
(4)元素g的单质与NaOH溶液反应的离子方程式为___________ 。
(5)上表所标元素的最高价氧化物对应水化物酸性最强的是___________ (写化学式,下同),碱性最强的是 ___________ 。
(6)科学家在研究元素周期表时,预言了在元素h的下一周期存在一种“类h”元素,该元素多年后被德国化学家文克勒发现,命名为锗(Ge),锗在周期表的位置为___________ 。预测h、Ge与氢气较难反应的是___________ (填元素名称)
(7)关于a原子结构和性质的判断如下:
①与H2O反应比Na剧烈;
②它的原子半径比Na小;
③它的氧化物暴露在空气中易吸收CO2;
④它的阳离子最外层电子数和钠离子的最外层电子数相同;
⑤它是还原剂;
⑥a单质应保存在煤油中,以隔绝空气;
⑦a单质在空气中燃烧生成过氧化物。
其中上述说法错误的是_____
| a | … | b | c | d | |||
| e | … | g | h | j |
(2)b、c、d三种元素的气态氢化物中,其中最稳定的是
(3)元素e与c能形成一种淡黄色物质,该物质与二氧化碳反应方程式为
(4)元素g的单质与NaOH溶液反应的离子方程式为
(5)上表所标元素的最高价氧化物对应水化物酸性最强的是
(6)科学家在研究元素周期表时,预言了在元素h的下一周期存在一种“类h”元素,该元素多年后被德国化学家文克勒发现,命名为锗(Ge),锗在周期表的位置为
(7)关于a原子结构和性质的判断如下:
①与H2O反应比Na剧烈;
②它的原子半径比Na小;
③它的氧化物暴露在空气中易吸收CO2;
④它的阳离子最外层电子数和钠离子的最外层电子数相同;
⑤它是还原剂;
⑥a单质应保存在煤油中,以隔绝空气;
⑦a单质在空气中燃烧生成过氧化物。
其中上述说法错误的是
| A.①④⑥⑦ | B.①②③ | C.③⑤⑥ | D.①②⑦ |
您最近一年使用:0次
名校
5 . 科学家对碱金属的认识始终在不断的探索中前进。
(1)1807年,英国化学家戴维在无氧条件下电解熔融的KOH,最后成功地得到了银白色的金属钾,实验中产生的金属液珠一接触水就剧烈反应,放出___________ 色气体,向溶液中滴入紫色石蕊试液,显______ 色,因为_______ (写出化学方程式)。
(2)利用碱金属与水的反应可测定某碱金属的相对原子质量。如下图所示,仪器本身连同水和干燥管以及其内的无水氯化钙的总质量为480.0g。

现将1.4 g某碱金属单质投入水中,立即用带有干燥管的塞子塞紧瓶口,反应完毕后,测得整套仪器的总质量为481.2 g。
①该金属元素的相对原子质量是___________ (结果保留两位小数),该元素可能是___________ 。
②若不用干燥管,测得的相对原子质量比实际相对原子质量___________ (填“偏大”“偏小”或“相等”),理由是___________ 。
(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第___________ 周期___________ 族。
Ⅱ.关于铷的下列说法中正确的是___________ (填序号,下同)。
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳
③Rb2O2与水能剧烈反应并释放出O2 ④它是极强的还原剂
⑤RbOH的碱性比同浓度的NaOH弱
(1)1807年,英国化学家戴维在无氧条件下电解熔融的KOH,最后成功地得到了银白色的金属钾,实验中产生的金属液珠一接触水就剧烈反应,放出
(2)利用碱金属与水的反应可测定某碱金属的相对原子质量。如下图所示,仪器本身连同水和干燥管以及其内的无水氯化钙的总质量为480.0g。

现将1.4 g某碱金属单质投入水中,立即用带有干燥管的塞子塞紧瓶口,反应完毕后,测得整套仪器的总质量为481.2 g。
①该金属元素的相对原子质量是
②若不用干燥管,测得的相对原子质量比实际相对原子质量
(3)最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,相对原子质量是85。根据材料回答下列问题:
Ⅰ.铷位于元素周期表的第
Ⅱ.关于铷的下列说法中正确的是
①与水反应比钠更剧烈 ②Rb2O在空气中易吸收水和二氧化碳
③Rb2O2与水能剧烈反应并释放出O2 ④它是极强的还原剂
⑤RbOH的碱性比同浓度的NaOH弱
您最近一年使用:0次
名校
解题方法
6 . 用脱脂棉包住约0.2gNa2O2粉末,置于石棉网上,往脱脂棉上滴水(如图),可观察到脱脂棉剧烈燃烧起来。
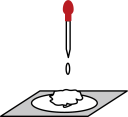
(1)由实验现象所得出的有关Na2O2和H2O反应的结论如下,请补充完整:
a.有______ 生成; b.反应放热;Na2O2与水反应的化学方程式是_________ 。
(2)某研究性学习小组拟用下图装置进行实验,以证明上述结论。

①用以验证结论a的实验方法:打开分液漏斗活塞,____________ 。
②用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到_____________ ,证明反应是放热的。
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有H2O2,使酚酞氧化漂白。同学们向反应后溶液中加入________ ,可观察到__________ ,说明有H2O2存在。

(1)由实验现象所得出的有关Na2O2和H2O反应的结论如下,请补充完整:
a.有
(2)某研究性学习小组拟用下图装置进行实验,以证明上述结论。

①用以验证结论a的实验方法:打开分液漏斗活塞,
②用以验证结论b的实验方法:反应前将q导管口连接一橡胶管浸入盛有水的水槽中,滴入水后,观察到
(3)实验(2)往试管中加水至固体完全溶解且不再有气泡生成后,取出试管,向试管中滴入酚酞溶液,发现溶液变红,振荡后,红色褪去。针对褪色现象,查阅资料发现原因之一是反应后溶液中有H2O2,使酚酞氧化漂白。同学们向反应后溶液中加入
您最近一年使用:0次
19-20高一·浙江·阶段练习
7 . 将2.84 g化合物A的粉末(含两种元素)投入足量水中剧烈反应后微热至无气泡现象,标准状况下共收集到0.672 L能使带火星木条复燃的气体B,同时得到溶液C (溶液C中只含三种元素);所得C溶液能被含0.04 mol HCl的盐酸溶液恰好中和,取中和后溶液进行焰色反应,火焰显浅紫色(隔蓝色钻玻璃观察)。试回答:
(1)A的化学式是______________ 。
(2)A的粉末与水反应的离子方程式为_______________ 。
(3)某些特殊场合下A可用作供氧剂,供氧过程中呼吸面具里有酸式盐生成,写出相关反应的化学方程式________ 。
(1)A的化学式是
(2)A的粉末与水反应的离子方程式为
(3)某些特殊场合下A可用作供氧剂,供氧过程中呼吸面具里有酸式盐生成,写出相关反应的化学方程式
您最近一年使用:0次
8 . 黄色超氧化钾(KO2)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究KO2的性质,请回答相关问题:
I.探究KO2与水的反应
II. 探究KO2与SO2的反应

(4)正确的操作依次是___________________ 。
①打开K1通入N2 ,排尽装置内原气体后关闭
②拆卸装置至实验完成
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(5)A装置发生的化学方程式为____________________ 。
(6)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是_____ 。
(7)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,将沉淀过滤、洗涤、__ ,称重为2.33g。
②将N溶液移入_______ (填仪器名称)中,用0.40mol/L酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液20.00mL。
③依据上述现象和数据,请写出该实验总反应的化学方程式___________ 。
I.探究KO2与水的反应
| 实验操作 | 现象 | 结论与解释 |
| (1)取少量KO2固体于试管中,滴加少量水,将带火星的木条靠近试管口,反应结束后,溶液分成两份 | 快速产生气泡,木条复燃 | 产生的气体是 |
| (2)一份滴加酚酞试液 | 先变红后褪色 | 可能的产物是 |
| (3)另一份滴加FeCl3溶液 | 观察到 |
II. 探究KO2与SO2的反应

(4)正确的操作依次是
①打开K1通入N2 ,排尽装置内原气体后关闭
②拆卸装置至实验完成
③检查装置气密性,然后装入药品
④打开分液漏斗活塞K2
(5)A装置发生的化学方程式为
(6)用上述装置验证“KO2与SO2反应生成O2”还存在不足,你的改进措施是
(7)改进后再实验,待KO2完全反应后,将装置C中固体加水溶解,配成50.00mL溶液,等分为M、N两份。
①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,将沉淀过滤、洗涤、
②将N溶液移入
③依据上述现象和数据,请写出该实验总反应的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 实验室回收利用废旧锂离子电池正极材料锰酸锂(LiMn2O4)的一种流程如下:

(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是_________ 。
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式_________ 。
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是_________ 。
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是_________ 。
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是________ 。
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入_________ 。

(1)废旧电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是
(2)“酸浸”时采用HNO3和H2O2的混合液体,可将难溶的LiMn2O4转化为Mn(NO3)2、LiNO3等产物。请写出该反应离子方程式
如果采用盐酸溶解,从反应产物的角度分析,以盐酸代替HNO3和H2O2混合物的缺点是
(3)“过滤2”时,洗涤Li2CO3沉淀的操作是
(4)把分析纯碳酸锂与二氧化锰两种粉末,按物质的量1:4混合均匀加热可重新生成LiMn2O4,升温到515℃时,开始有CO2产生,同时生成固体A,比预计碳酸锂的分解温度(723℃)低很多,可能的原因是
(5)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH=7.7。请补充由上述过程中,制得的Mn(OH)2制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2SO4、Na2CO3、C2H5OH]:向Mn(OH)2中边搅拌边加入
您最近一年使用:0次
2018-05-30更新
|
1317次组卷
|
3卷引用:【全国校级联考】江苏省南京市金陵中学、海安高级中学、南京外国语学校2018届高三第四次模拟考试化学试题
名校
10 . 氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→______________ 。
(2)检查好装置的气密性,点燃酒精灯前需进行的实验操作是_______________ 。
(3)写出制备氢化铝锂的化学方程式:__________________ 。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。

(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________ 。
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________ 。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________ 。
(6)在标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为_____________ (用含a、V1、V2 的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________ (填“偏高”“偏低”或“无影响”)。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):

(1)装置的连接顺序(从左至右)为A→
(2)检查好装置的气密性,点燃酒精灯前需进行的实验操作是
(3)写出制备氢化铝锂的化学方程式:
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。

(4)写出氢化锂与无水三氯化铝反应的化学方程式:
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是
(6)在标准状况下,反应前量气管读数为V1 mL,反应完毕并冷却之后,量气管读数为V2 mL。该样品的纯度为
您最近一年使用:0次
2017-12-25更新
|
662次组卷
|
4卷引用:江西名校学术联盟(临川一中、景德镇一中、雁潭一中等)2018届高三教学质量检测考试(二)理综-化学试题



