1 . 往下列烧杯中分别滴加一定量的饱和氯化镁溶液,一定会产生沉淀的是
| 化学试剂 |  |  |  |  |
| 选项 | A | B | C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 利用工业废渣(主要成分为MgCO3、MgSiO3和少量Fe2O3)制备MgCO3•3H2O。
实验步骤如下:
步骤1:将废渣加入30%H2SO4溶液中,待其充分反应后进行操作1。
步骤2:向“步骤1”所得的溶液中加入有机萃取剂HX(密度小于水)萃取Fe3+,静置分层后进行操作2。
步骤3:边搅拌边向“步骤2”所得的水溶液中滴加Na2CO3溶液,至有大量沉淀生成,过滤、用蒸馏水洗涤、干燥,得到MgCO3•3H2O。
回答下列问题:
(1)步骤1发生反应时温度控制在80℃,边加入废渣边搅拌。
①适宜的加热方式为____ ,含镁化合物发生反应的离子方程式为MgSiO3+2H+=Mg2++H2SiO3、____ 。
②判断废渣充分反应的方法为____ ,所加H2SO4不宜过多的原因是____ 。
(2)“步骤2”中HX萃取Fe3+的原理为Fe3+(aq)+3HX=FeX3(org)+3H+(aq),org表示有机相。
①“操作1”和“操作2”的名称分别为____ 、____ ,萃取过程中水溶液的pH将____ (填“升高”“降低”或“不变”)。
②萃取的具体操作为将萃取剂HX加入“步骤1”所得的溶液中____ 静置;重复多次“步骤2”,其目的是____ 。
(3)“步骤3”中检验MgCO3•3H2O洗涤干净的具体操作为____ 。
实验步骤如下:
步骤1:将废渣加入30%H2SO4溶液中,待其充分反应后进行操作1。
步骤2:向“步骤1”所得的溶液中加入有机萃取剂HX(密度小于水)萃取Fe3+,静置分层后进行操作2。
步骤3:边搅拌边向“步骤2”所得的水溶液中滴加Na2CO3溶液,至有大量沉淀生成,过滤、用蒸馏水洗涤、干燥,得到MgCO3•3H2O。
回答下列问题:
(1)步骤1发生反应时温度控制在80℃,边加入废渣边搅拌。
①适宜的加热方式为
②判断废渣充分反应的方法为
(2)“步骤2”中HX萃取Fe3+的原理为Fe3+(aq)+3HX=FeX3(org)+3H+(aq),org表示有机相。
①“操作1”和“操作2”的名称分别为
②萃取的具体操作为将萃取剂HX加入“步骤1”所得的溶液中
(3)“步骤3”中检验MgCO3•3H2O洗涤干净的具体操作为
您最近一年使用:0次
2022-10-19更新
|
130次组卷
|
2卷引用:广东省河源中学2022-2023学年高三10月教学质量检测化学试题
名校
3 . 在给定条件下,下列选项所示的物质间转化均能实现的是
A.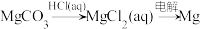 |
B. |
C.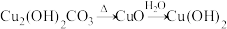 |
D.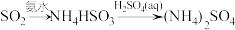 |
您最近一年使用:0次
2022-10-14更新
|
221次组卷
|
2卷引用:江苏南京金陵中学2022-2023学年高二上学期10月月考化学试题
4 . Ⅰ.氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为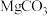 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
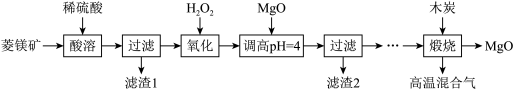
已知:① 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。
(1)酸溶时,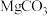 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______ 。
(2)滤渣1的化学式为_______ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为_______ 。
Ⅱ.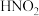 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。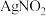 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(4)人体正常的血红蛋白含有 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
(5)某同学把新制的氯水(主要成分 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成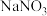 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:_______ 。
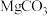 ,另含少量杂质
,另含少量杂质 和
和 等)为原料制备高纯氧化镁的实验流程如下:
等)为原料制备高纯氧化镁的实验流程如下:
已知:①
 不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有
不溶于稀硫酸和稀盐酸,②滤渣2中除了过量的MgO外,还含有 。
。(1)酸溶时,
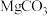 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 除去,写出“氧化”流程的离子方程式为
除去,写出“氧化”流程的离子方程式为Ⅱ.
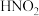 是一种弱酸,且不稳定,易分解生成NO和
是一种弱酸,且不稳定,易分解生成NO和 ;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把
;它能被常见的强氧化剂氧化:在酸性溶液中它也是一种氧化剂,如能把 氧化成
氧化成 。
。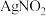 是一种难溶于水、易溶于酸的化合物,试回答下列问题:
是一种难溶于水、易溶于酸的化合物,试回答下列问题:(4)人体正常的血红蛋白含有
 ,若误食亚硝酸盐(如
,若误食亚硝酸盐(如 ),则导致血红蛋白中的
),则导致血红蛋白中的 转化为
转化为 而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。
而中毒,服用维生素C可解毒。下列叙述不正确的是_______(填字母)。| A.亚硝酸盐被还原 | B.维生素C是还原剂 |
C.维生素C将 还原为 还原为 | D.亚硝酸盐是还原剂 |
 )加到
)加到 溶液中,观察到氯水褪色,同时生成
溶液中,观察到氯水褪色,同时生成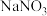 和HCl,请写出反应的离子方程式:
和HCl,请写出反应的离子方程式:
您最近一年使用:0次
2022-10-12更新
|
309次组卷
|
2卷引用:江苏省海安实验、句容三中、心湖高中2022-2023学年高一10月联考化学试题
5 . 过氧化镁( )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
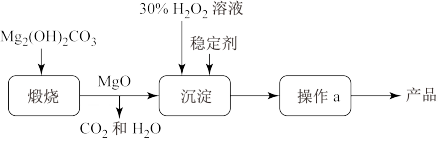
(1)过氧化镁 中氧元素的价态为
中氧元素的价态为_______ 。煅烧 的化学反应方程式
的化学反应方程式_______ 。
(2)上述制备过程中加入稳定剂的作用是_______ ;操作a为_______ 。
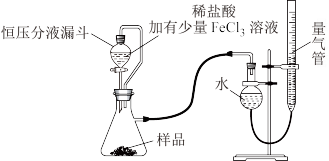
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①_______ ;
②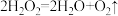 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是_______ 。
(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、_______ 。
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为_______ 。(该实验条件下 密度为
密度为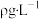 )
)
 )不溶于水,与酸反应生成
)不溶于水,与酸反应生成 ,在医学上可作解酸剂。常温下
,在医学上可作解酸剂。常温下 较稳定,加热时会分解生成
较稳定,加热时会分解生成 和MgO。MgO与
和MgO。MgO与 反应可制得
反应可制得 ,同时放出大量热。一种制备
,同时放出大量热。一种制备 的流程如图所示:请回答下列问题:
的流程如图所示:请回答下列问题:
(1)过氧化镁
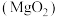 中氧元素的价态为
中氧元素的价态为 的化学反应方程式
的化学反应方程式(2)上述制备过程中加入稳定剂的作用是
 产品中常会混有少量MgO,实验室可通过多种方案测定样品中
产品中常会混有少量MgO,实验室可通过多种方案测定样品中 的含量。某研究小组拟用下图装置测定样品(含
的含量。某研究小组拟用下图装置测定样品(含 杂质)中
杂质)中 的含量。
的含量。
(3)研究小组的实验原理是(用化学方程式表示)
①
②
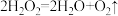 ,稀盐酸中加入
,稀盐酸中加入 溶液的作用是
溶液的作用是(4)实验中使用恒压分液漏斗的优点是:使分液漏斗中的溶液顺利滴下、
(5)该小组记录的实验数据如下,样品的质量为mg;反应开始前量气管的读数为amL;反应结束后量气管的读数为bmL,则样品中过氧化镁的质量分数为
 密度为
密度为 )
)
您最近一年使用:0次
解题方法
6 . 下列除去杂质的方法正确的是
| A.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体 |
| B.除去N2中的少量O2:通过灼热的CuO粉末,收集气体 |
| C.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
| D.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
您最近一年使用:0次
名校
7 . 短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的简单氢化物的水溶液呈碱性,X、W同主族;Y的最外层电子数是次外层的3倍;金属元素Z的最外层电子数等于其K层电子数; W、Q的最外层电子数之和是Y的最外层电子数的2倍,下列说法不正确的是
| A.X、Y两种元素能形成多种化合物 |
| B.工业上电解熔融Z的氯化物来获得Z单质 |
| C.X、Y、W三种元素气态氢化物的稳定性: Y>X>W |
| D.Q的氧化物对应的水化物一定为强酸 |
您最近一年使用:0次
2022-09-30更新
|
1212次组卷
|
3卷引用:四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题
四川省内江市资中县第二中学2023-2024学年高二下学期3月月考化学试题贵州省六校联盟2022-2023学年高三上学期高考实用性联考(一)理科综合化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练
名校
8 . 镁及其合金是用途很广的金属材料。大量的镁是从海水中提取的,其中的主要步骤如图:
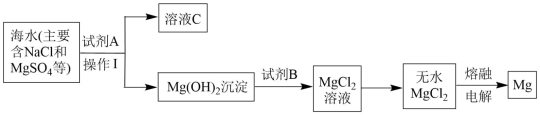
(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用_______ 。
(2)操作分离得到Mg(OH)2沉淀的方法是_______ 。
(3)试剂B可以选用_______ (填化学式)。
(4)溶液C中的阴离子除了OH-外,主要还含有_______ (填离子符号)。
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程_______ 。
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是_______ 、_______ 过滤,洗涤,干燥。

(1)为了使MgSO4转化为Mg(OH)2 ,综合经济角度考虑,试剂A可选用
(2)操作分离得到Mg(OH)2沉淀的方法是
(3)试剂B可以选用
(4)溶液C中的阴离子除了OH-外,主要还含有
(5)工业上常用电解法冶炼一些非常活泼的金属,写出用无水MgCl2冶炼镁的化学方程
(6)海水提镁时,由MgCl2溶液得到MgCl2·6H2O晶体的具体操作是
您最近一年使用:0次
2022-09-21更新
|
328次组卷
|
2卷引用:云南省楚雄天人中学2021-2022学年高二上学期12月月考化学试题(B卷)
9 . 将0.1 mol的镁、铝混合物溶于100 mL 2 mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160 mL时,回答下列问题
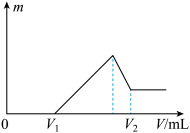
(1)写出0 - V1发生的离子反应方程式为:_______ 。
(2)写出V1 - V2发生的离子反应方程式为:_______ 、_______ 、_______ 。
(3)镁的物质的量为_______ 。
(4)V2=_______ mL。

(1)写出0 - V1发生的离子反应方程式为:
(2)写出V1 - V2发生的离子反应方程式为:
(3)镁的物质的量为
(4)V2=
您最近一年使用:0次
10 . 写出下列物质之间转化的方程式。
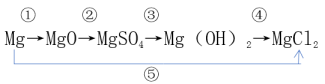
①_______
②_______
③_______
④_______
⑤_______
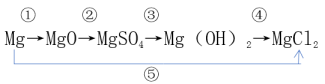
①
②
③
④
⑤
您最近一年使用:0次



