解题方法
1 . 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。请回答下列问题:
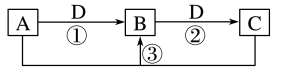
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式是___________ ;工业上制取A的离子方程式为___________ 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为___________ 。将B、C的混合气体溶于氢氧化钠溶液中的化学方程式___________ 。
(3)若D是氯碱工业的主要产品之一,B物质具有两性,则反应②的离子方程式是___________ 。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为___________ 。某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因:___________ 。

(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式是
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
(3)若D是氯碱工业的主要产品之一,B物质具有两性,则反应②的离子方程式是
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 某工厂从含硫酸钡、氧化铜、氧化亚铁、氧化铝和少量氧化银的废渣中回收金属的工艺流程如图所示:

(1)写出酸浸过程中使用的是稀硝酸,写出此过程中氧化亚铁所发生反应的离子方程式:____ ;滤渣①是____ (填“强”“弱”或“非”)电解质。
(2)加入过量铁粉,被还原的金属阳离子有____ 。
(3)A是一种红棕色固体,A的化学式为____ ,由B电解为单质C的化学方程式为____ 。
(4)写出滤液③通入过量二氧化碳,发生主反应的离子方程式____ 。
(5)饮用水中的 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某兴趣小组提出以下方案:在碱性条件下,用铝粉还原NO
的浓度,某兴趣小组提出以下方案:在碱性条件下,用铝粉还原NO ,还原产物为N2,方案中发生的反应如下(配平该反应离子方程式):
,还原产物为N2,方案中发生的反应如下(配平该反应离子方程式):___ Al+___ NO +
+___ OH−+___ H2O=___ [Al(OH)4]−+___ N2↑。

(1)写出酸浸过程中使用的是稀硝酸,写出此过程中氧化亚铁所发生反应的离子方程式:
(2)加入过量铁粉,被还原的金属阳离子有
(3)A是一种红棕色固体,A的化学式为
(4)写出滤液③通入过量二氧化碳,发生主反应的离子方程式
(5)饮用水中的
 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO 的浓度,某兴趣小组提出以下方案:在碱性条件下,用铝粉还原NO
的浓度,某兴趣小组提出以下方案:在碱性条件下,用铝粉还原NO ,还原产物为N2,方案中发生的反应如下(配平该反应离子方程式):
,还原产物为N2,方案中发生的反应如下(配平该反应离子方程式): +
+
您最近一年使用:0次
名校
解题方法
3 . 粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、MgO和SiO2等物质。用硫酸铵固体等试剂提取粉煤灰中Al2O3并制取铝的工艺流程如图:

(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为__________ 。
(2) “滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为______________ 、______________ 。
(3)将“滤液Ⅱ”通过________ 、________ 、过滤、洗涤、干燥后得到的晶体可返回__________ 工序(填写流程图中的工序操作名称)中循环利用。
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为____________________ 。
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为______________________________________ 。
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,若在整个流程中铝的损耗率为10%,则原粉煤灰中铝的质量分数为________ 。

(1)已知烟气中含有NH3,煅烧工序中Al2O3参与反应的化学方程式为
(2) “滤渣Ⅰ”和“滤渣Ⅲ”主要成分的化学式分别为
(3)将“滤液Ⅱ”通过
(4)向“滤液Ⅲ”中通入过量CO2,生成沉淀的离子方程式为
(5)电解Al2O3制备Al需要冰晶石(Na3AlF6)作助熔剂。Na3AlF6可由Al(OH)3、Na2CO3和HF反应制得,反应的化学方程式为
(6)某工厂利用上述流程从m吨粉煤灰中制得n吨Al2O3,若在整个流程中铝的损耗率为10%,则原粉煤灰中铝的质量分数为
您最近一年使用:0次
名校
解题方法
4 . A、B、C、D是中学化学中的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如右图所示(反应中的其他产物已略去)。请填空:

(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是________ 。
②若D是强碱,则反应②的离子方程式是___________________________ 。
(2)若A为淡黄色固体单质,D为空气中的主要成分,则请写出A与C的浓溶液发生反应的化学方程式___________________________ 。
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是______________________________ 。
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则请写出工业制取A的化学方程式______________ 。
②若A是某强酸的稀溶液,则A的化学式可能是_________ 。

(1)若B是常见的两性氢氧化物
①若D是强酸,则能确定A中肯定含的离子的化学式是
②若D是强碱,则反应②的离子方程式是
(2)若A为淡黄色固体单质,D为空气中的主要成分,则请写出A与C的浓溶液发生反应的化学方程式
(3)若A、B、C的的焰色反应都呈黄色,D是一种无色无味的气态酸性氧化物,则反应③的离子方程式是
(4)若D是生产、生活中用量最大、用途最广的金属单质
①若A可用于自来水消毒,则请写出工业制取A的化学方程式
②若A是某强酸的稀溶液,则A的化学式可能是
您最近一年使用:0次
2020-10-12更新
|
159次组卷
|
2卷引用:福建省福州市第四中学2021届高三10月月考化学试题
5 . A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
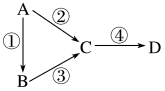
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式___________________________________________________ 。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________________________________ 。实验室中检验气体B存在用的试剂或用品为________________ 。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________ 。请写出②的离子方程式_______________________________ 。

(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是
您最近一年使用:0次
2020-10-09更新
|
198次组卷
|
2卷引用:江西省南昌市新建一中2021届高三上学期第一次月考化学试题
名校
6 . A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:___________ 。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:________ 。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:_________ 。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同主族,且溶液均显碱性,其中C可用作粘合剂。写出④反应的化学方程式:______ 。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:______ 。

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同主族,且溶液均显碱性,其中C可用作粘合剂。写出④反应的化学方程式:
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于刻蚀印刷铜电路板,写出该反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 化合物X(仅含三种短周期元素)是一种储氢材料,X中某种元素的单质常用来制造信号弹和烟火,某研究小组为了探究X的组成和性质,设计并完成了如下实验。(金属互化物是全部由金属元素组成的化合物)
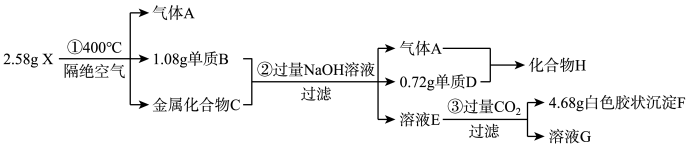
(1)写出H的电子式________ 。
(2)X在400℃下分解的化学方程式________ 。
(3)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为________ 。

(1)写出H的电子式
(2)X在400℃下分解的化学方程式
(3)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。请针对以下不同情况回答问题:

(1)若A、B、C均含同一种常见的金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为___ (填元素符号)。
②将该金属单质与某氧化物在高温下剧烈反应,可用于焊接铁轨反应的方程式为___ 。
③A溶液与C溶液反应的离子方程式为___ 。
(2)若A、B、C均为白色固体,其焰色反应均为黄色,水溶液均为碱性。
①当C溶液中混有B的杂质时,如何除去___ ?(用离子方程式表示)。
②将一定量的CO2通入A的溶液中,充分反应后,再向混合液中逐滴滴加盐酸。所加盐酸的体积与生成的气体的关系如图所示,则滴加盐酸前,溶液中的溶质为___ 。


(1)若A、B、C均含同一种常见的金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀。
①A中含有的金属元素为
②将该金属单质与某氧化物在高温下剧烈反应,可用于焊接铁轨反应的方程式为
③A溶液与C溶液反应的离子方程式为
(2)若A、B、C均为白色固体,其焰色反应均为黄色,水溶液均为碱性。
①当C溶液中混有B的杂质时,如何除去
②将一定量的CO2通入A的溶液中,充分反应后,再向混合液中逐滴滴加盐酸。所加盐酸的体积与生成的气体的关系如图所示,则滴加盐酸前,溶液中的溶质为

您最近一年使用:0次
名校
解题方法
9 . A、B、C是单质,其中A是金属,各种物质间的转化关系如下图,根据图示转化关系回答:

(1)写出下列物质的化学式:A_______ ,B______ ,乙____ 。
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式_______ ;
②甲与NaOH溶液反应的化学方程式______ ;
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为______ ,转移电子的物质的量为______ 。
(4)A物质在高温作用下能与氧化铁发生反应,请写出反应的化学方程式____ 。

(1)写出下列物质的化学式:A
(2)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式
②甲与NaOH溶液反应的化学方程式
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为
(4)A物质在高温作用下能与氧化铁发生反应,请写出反应的化学方程式
您最近一年使用:0次
解题方法
10 . 以某镍矿(主要成分为NiS、CuS、FeS、SiO2等)为原料制备一种多孔结构的细小镍晶粒,可用作有机物氢化反应的催化剂和储氢材料。工艺流程如图所示:[已知金属活动顺序为:Fe>Ni>(H)>Cu]

(1)已知该镍矿煅烧后生成Ni2O3,而加压酸浸液A中含有Ni2+,写出有关镍元素的加压酸浸的化学方程式___ 。
(2)已知Ni(CO)4的沸点是42.2℃,Ni(S)+4CO(g) Ni(CO)4(g)的平衡常数与温度的关系如下:
Ni(CO)4(g)的平衡常数与温度的关系如下:
步骤①、步骤②的最佳温度分别是___ 、___ (填选项代号)
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(3)“高温熔融”时通入氩气的目的是___ 。
(4)“碱浸”是整个流程的核心步骤,该步骤的目的是___ ,发生反应的离子方程式为___ 。
(5)浸出液B可以回收,重新生成铝以便循环利用,请设计简单的回收流程:
(示例: )浸出液B→
)浸出液B→___ 。
(6)镍硫化合物中会含有少量的CuS,也可以采用电解精炼的方法获得纯镍,流程为:

电解制粗镍时阳极发生的主要电极反应式为___ ;
精炼过程需控制pH2~5的原因___ 。

(1)已知该镍矿煅烧后生成Ni2O3,而加压酸浸液A中含有Ni2+,写出有关镍元素的加压酸浸的化学方程式
(2)已知Ni(CO)4的沸点是42.2℃,Ni(S)+4CO(g)
 Ni(CO)4(g)的平衡常数与温度的关系如下:
Ni(CO)4(g)的平衡常数与温度的关系如下:温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5× | 2 | 1.9× |
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(3)“高温熔融”时通入氩气的目的是
(4)“碱浸”是整个流程的核心步骤,该步骤的目的是
(5)浸出液B可以回收,重新生成铝以便循环利用,请设计简单的回收流程:
(示例:
 )浸出液B→
)浸出液B→(6)镍硫化合物中会含有少量的CuS,也可以采用电解精炼的方法获得纯镍,流程为:

电解制粗镍时阳极发生的主要电极反应式为
精炼过程需控制pH2~5的原因
您最近一年使用:0次



